Доказательная медицина
Доказа́тельная медици́на, или медицина, основанная на доказательствах (англ. evidence-based medicine), — подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных вмешательств принимаются, исходя из имеющихся доказательств их эффективности и безопасности, а такие доказательства подвергаются оценке, сравнению, обобщению и широкому распространению для использования в интересах пациентов. Отличием доказательной медицины от традиционной является использование достоверных научных доказательств эффективности лекарств и медицинских манипуляций.
Основная особенность доказательной медицины — критическая оценка имеющихся доказательств. Важный инструмент доказательной медицины — систематические обзоры, в которых может использоваться метаанализ.
При лечении каждого больного доказательная медицина предполагает осмысленное, точное и добросовестное использование результатов исследований, основываясь на лучших из них. Клинические рекомендации, основанные на принципах доказательной медицины, должны указывать степень уверенности в их положениях. Подобные степени обычно называют уровнями достоверности доказательств и уровнями убедительности рекомендаций, обозначая римскими цифрами или латинскими буквами.
Доказательная медицина, начав активно развиваться в 1990-е годы, столкнулась с рядом проблем, вызванных неявной недостоверностью в публикациях. Спонсируемые коммерческими предприятиями исследования часто бывают смещены в сторону благоприятных для компаний исходов, а исследования, показавшие нежелательные для спонсора результаты, могут оказаться неопубликованными и недоступными для врачей и пациентов. В ситуации, когда большинство исследований спонсируются отраслью, опубликованные доказательства по части исследуемых вмешательств могут оказаться неполными и смещёнными. В результате пациентам могут назначаться более дорогие, более опасные или (и) менее эффективные препараты.
Доказательная медицина во многом строится на исследованиях, проводимых с использованием методов эпидемиологии и биостатистики.
Содержание
История
Одна из первых известных попыток применить научный метод в медицине — опыты по поиску причины цинги и средства против неё, проведённые Джеймсом Линдом в 1747 году. Однако из-за сопротивления высокопоставленных авторитетов и отсутствия системы распространения научных знаний открытие Линда осталось неизвестным для многих его коллег.
Однако, до сих пор многие медицинские вмешательства, в том числе «общепризнанные», не были подвергнуты строгой научной проверке.
Постепенно в медицине возникали идеи, повышающие её эффективность. Ныне это, например, «Золотой стандарт терапии» и «Препарат выбора».
Профессор Арчибальд Кокрейн (англ. Archibald Cochran) в середине XX века задумался о том, насколько в действительности эффективны современные ему методы лечения инфекционных заболеваний. Когда после приёма лекарства пациенту становится лучше, это не всегда связано с действием самого лекарства, примерно в трети случаев работает эффект плацебо, который издавна используется врачами.
В 1960-е стали очевидными недостатки традиционного подхода к принятию медицинских решений, в котором врач или группа экспертов выбирали, что из имеющихся доказательств будет принято к рассмотрению и как эти доказательства они будут согласовывать со своими убеждениями, предпочтениями и другими обстоятельствами.
В 1967 году Элван Фейнштейн (Alvan Feinstein) в книге «Клиническое суждение» рассмотрел механизм принятия медицинских решений, уделив основное внимание роли клинических рассуждений и предубеждений врача.
В 1972 году А. Кокрейн опубликовал работу «Эффективность и результативность», в которой описал отсутствие доказательств у множества медицинских практик, которые ранее считались эффективными, и показал необходимость проведения контролируемых испытаний.
C 1973 года Джон Уэннберг (John Wennberg) публиковал описание различий во врачебной практике у разных докторов.
В 1980-е Дэвид М. Эдди (David M. Eddy) описывал ошибки в клинических рассуждениях и пробелы в доказательствах эффективности медицинских практик.
В середине 1980-х годов А. Фейнштейн, Дэвид Сакетт (англ. David Lawrence Sackett) и другие авторы опубликовали учебники по клинической эпидемиологии, в которых адаптировали методы эпидемиологии для принятия врачебных решений.
Термин «основанный на доказательствах» (англ. evidence based) впервые использовал Д. М. Эдди в своей работе, посвящённой руководящим принципам клинической практики и страхового покрытия лечения, которую он не опубликовал, но использовал на семинарах и в лекциях с 1987 года (её текст опубликовал Американский медицинский колледж в конце 1980-х). В марте 1990 года в Журнале Американской медицинской ассоциации (JAMA) опубликована его статья (Eddy, D. M. Clinical decision making: from theory to practice. Anatomy of a decision // JAMA: The Journal of the American Medical Association. — 1990. — Vol. 263, no. 3. — P. 441–443. — doi:10.1001/jama.263.3.441. — PMID 2294311.), где он использовал и определил термин «основанный на доказательствах».
Термин «доказательная медицина» (англ. evidence-based medicine) с осени 1990 года использовал Гордон Гайят (Gordon Guyatt) в своих лекциях в Университете Мак-Мастера в Торонто. Первая публикация с ним появилась в 1991 году, где термин был использован для описания нового подхода к обучению медицинской практике. (Guyatt G.H. Evidence-based medicine. ACP. J. Club. 1991; 114 (2): A16.)
В научной публикации термин «доказательная медицина» впервые использовал канадский эпидемиолог Д. Саккет в 1990-е годы. (Sackett, D. L. Evidence-Based Medicine: How to Practice and Teach Ebm / D. L. Sackett, S. E. Straus, W. S. Richardson … [и др.]. — Edinburgh : Churchill Livingstone, 2000. — 261 с.)
В широкий обиход этот термин был введён группой канадских учёных из Университета Мак-Мастера в 1996 году, вскоре после того, как в результате ревизии всех известных медицинских вмешательств оказалось, что каждое второе из назначенных врачами вмешательств не имело доказательств своей эффективности
В настоящее время доказательная медицина используется для совершенствования клинической практики, на Западе она внедрена во все сферы медицинской деятельности, начиная с общения с пациентами.
В 2010-х термин «доказательная медицина» в публичном медиапространстве стал обесцениваться, он используется в отличных от исходного смысла значениях, в том числе маркетинговых целях. Но среди врачей постепенно растёт стремление привести медицину к общему знаменателю, избавить диагнозы и клинические методики от зависимости от мнений отдельных, пусть и авторитетных, людей в пользу объективных критериев.
Принципы доказательной медицины
Д. Саккет определил доказательную медицину как систематическое использование лучших из существующих доказательств эффективности при выборе метода лечения.
Основной принцип доказательной медицины — прозрачность. Любое клиническое решение (выбор варианта лечения из возможных альтернатив) должно быть обосновано доказательствами, которые могут быть проверены другими людьми.
Второй принцип — равноправие. Авторитет, статус и личный опыт не должны влиять на выбор лечения, такой выбор должен основываться на высококачественных доказательствах преимуществ конкретного вмешательства.
Клинические исследования
В основе доказательной медицины лежит проверка эффективности и безопасности методик диагностики, профилактики и лечения (в том числе применяемых препаратов) в клинических исследованиях. Под практикой доказательной медицины понимают использование данных, полученных из клинических исследований, в повседневной клинической работе врача.
Добыть доказательства эффективности или неэффективности какого-либо метода лечения или диагностического исследования непросто: это трудоемкий и дорогостоящий процесс.
Клинические исследования в доказательной медицине строятся по определённым принципам. Одним из ключевых моментов является «двойной слепой метод» клинического испытания (clinical trial): при проведении испытания ни врач, ни сам пациент не знают, получает ли пациент лекарство (лечение) или плацебо (имитацию лечения). Пациент подписывает согласие получать как одно, так и другое. Распределение по группам получающих лекарство и получающих плацебо проводится случайным образом (рандомизированное контролируемое испытание). В роли плацебо может выступать «пустышка», если для заболевания ещё не существует стандартного эффективного лечения. Если стандартная терапия существует, то используют не «пустышку», а общепринятый метод лечения, иначе это было бы неэтичным и опасным для жизни и здоровья пациентов. После завершения полного курса лечения проводится статистический анализ результатов. Плацебо-контроль нужен потому, что доказано: любые виды вмешательства, в том числе и плацебо, у 70 % пациентов с функциональными (нетяжелыми) и у 50 % с органическими (тяжелыми) нарушениями приводят к временному неспецифическому эффекту — другими словами, не менее половины пациентов чувствуют улучшения от плацебо. Чтобы препарат был признан действующим, эффект от его приёма должен быть выше, чем у плацебо, и эффективным, когда результат значительно выше плацебо.
Сегодня определены «золотые стандарты» в лечении и диагностике различных заболеваний. Например, в онкологии «золотым стандартом» диагностики считаются морфологические исследования, при которых изучается клеточный состав ткани поражённого органа. «Золотыми стандартами» диагностики заболеваний желудка и 12-перстной кишки является фиброгастроскопия, а ранних нарушений функции сердечных камер — ультразвуковое исследование. Все остальные методы диагностики этих же заболеваний находятся с «золотыми стандартами» в известном согласии.
Для целей фармацевтических исследований и регулирования общепризнаны правила проведения клинических исследований, в том числе клинических испытаний, изложенные в стандарте GCP (good clinical practice, «надлежащая клиническая практика»), а также правила производства лекарственных средств (стандарт GMP) и выполнения лабораторных исследований (стандарт GLP).
Методология доказательной медицины критикуется с самых разных позиций, однако у нас нет другого инструмента для обеспечения эффективности и безопасности лечения.
Качество клинических исследований сильно различается на разных территориях. Во многих странах нет надлежащего контроля за качеством клинических исследований или нет традиций проведения качественных исследований. Например, анализ данных крупного исследования TOPCAT показал, что в определённых географических областях были допущены серьёзные нарушения методики исследования (в том числе на территории бывшего СССР). В частности, многие испытуемые в исследовательских центрах на территории бывшего СССР не получали лекарство вопреки записям в протоколах. Некоторые эксперты предположили, что кто-то из персонала продал препарат на сторону. По сравнению с исследованиями в Северной и Южной Америках низкое качество исследований в России и Грузии. Выявлена тенденция, что в развивающихся странах качество исследований ниже, чем в развитых.
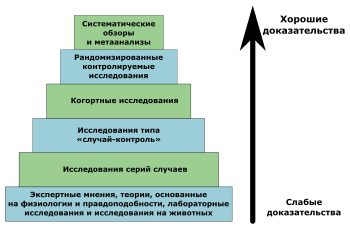
Уровни доказательности
Начало было положено в Канаде в 1979 г., когда эффективность вмешательства стали оценивать в соответствии с качеством полученных доказательств:
I. Доказательства, полученные как минимум из одного правильно рандомизированного контролируемого исследования.
I-1. Доказательства, полученные из хорошо спланированных когортных или аналитических исследований «случай—контроль», предпочтительно из более чем одного центра или более чем одной исследовательской группы.
II-2. Доказательства, полученные из сравнений времен и мест с вмешательством или без него. Драматические результаты в неконтролируемых экспериментах (такие как результаты введения пенициллина в 1940-х годах) также могут рассматриваться как доказательства такого типа.
III. Мнения уважаемых авторитетов, основанные на клиническом опыте, описательных исследованиях или отчетах экспертных комитетов.
Позднее эта рейтинговая система развивалась и усложнялась.
Развитие идей доказательной медицины
Международная система доказательной медицины быстро развивается: с момента её становления в начале 90-х годов и по настоящее время число центров, монографий и форумов по проблеме исчисляется десятками, количество публикаций — тысячами. Агентство политики здравоохранения и науки США субсидировало в 1997 году сроком на 5 лет 12 таких центров, созданных при ведущих университетах и научных организациях различных штатов; растёт число центров по отдельным проблемам (здоровье детей, первичная помощь, общая практика, психическое здоровье и др.).
Общим для всего направления является использование принципа доказательности на любом уровне принятия решений — от государственной программы до назначения индивидуальной терапии.
Крупнейшие мировые организации — Кокрановское сотрудничество и EBMG.
Ограничения доказательной медицины
Хотя целью доказательной медицины и является способствование принятию клинических решений на основе имеющихся научных доказательств, но существует множество изъянов в имеющихся научных данных, в их публичной доступности и в применимости их к ситуации, касающейся конкретного пациента.
Доказательная медицина имеет ценность, только пока доказательная база того или иного лечебного вмешательства является полной и эффективной. Выборочная публикация результатов клинических испытаний может привести к нереалистичной оценке эффективности лекарственного средства и изменить соотношение риск/польза.
Так, в публикации ВОЗ отмечается, что имеющиеся доказательства эффективности лекарственных средств могут быть дефектными из-за плохого дизайна исследования, неполной публикации его результатов, источника финансирования исследования и необъективности публикации. Когда исследования лекарственных средств спонсируются фармацевтическими компаниями, вероятность благоприятных результатов в 4—5 раз выше, чем в случаях, когда финансирование идёт из других источников.
Например, в психиатрии имеют место:
- явное и скрытое влияние законных интересов спонсоров исследования на его результаты, приводящее к тому, что результаты исследований III фазы часто оказываются сомнительными;
- постоянная тенденция предания гласности лишь положительных результатов исследований, припрятывания и замалчивания отрицательных — у работ с положительными результатами в два раза больше шансов быть опубликованными (как правило, в более престижных и соответственно в более цитируемых изданиях); существует тенденция многократно публиковать одни и те же результаты, по-разному оформленные;
- использование в метаанализах лишь наиболее благоприятных результатов исследований.
По утверждению Петера Гётше, многие систематические обзоры клинических испытаний содержат ошибки, связанные с получением первоначальных данных. Гётше подвергал критике слабые систематические обзоры клинических испытаний и редакторскую политику ведущих медицинских рецензируемых журналов. Вместе с соавторами Гётше критиковал методы исследований и интерпретацию результатов, применявшиеся другими учёными при проведении систематических обзоров, где использовалось плацебо.
Как отмечает Бен Голдакр, промышленность финансирует абсолютное большинство клинических исследований лекарств, и умалчивание отрицательных результатов исследований компаниями, производящими лекарственные препараты, — обычное дело. Иногда спонсируемые промышленностью исследования имеют плохой дизайн (например, сравнение нового препарата с существующим препаратом в неэффективной дозе). Иногда пациенты отбираются в исследование таким образом, чтобы сделать положительный результат более вероятным. Кроме того, случается, что данные анализируются по ходу исследования, и если исследование предположительно ведёт к негативным данным о препарате, то его прекращают преждевременно и результаты не публикуются. Если же исследование приводит к положительным данным, оно тоже может быть прекращено досрочно, чтобы долгосрочные побочные эффекты не были замечены. Голдакр указывает, что это системная ошибка всех современных исследований: отрицательные результаты остаются неопубликованными, что представляет собой «болезнь» всей медицины и научных кругов.
Примеры
Одним из примеров противоречивости доказательной базы некоторых широко используемых препаратов является ситуация со статинами — препаратами, снижающими уровень холестерина липопротеинов низкой плотности, применяющимися для лечения атеросклероза и профилактики развития сердечно-сосудистых заболеваний, — неоднократно подвергалась сомнению. Статины являются лекарствами «первой линии» для лечения нарушений обмена холестерина по рекомендациям всех ведущих кардиологических ассоциаций, в результате чего в 2019 году аторвастатин стал самым назначаемым препаратом в США. Однако проведённый в 2013 метаанализ показал, что влияние статинов на продолжительность жизни у людей с невысоким риском сердечно-сосудистых заболеваний незначительно, и предположил, что их пользу перевешивает риск тяжёлых побочных действий — диабета и миопатии. В 2013 году Петер Гётше, анализируя данные кокрановского обзора 2011 года, отмечал, что описанное исследованием снижение общей смертности на 16 %, во-первых, не так значительно, как может показаться (в клинических испытаниях, данные которых объединены в этом обзоре, умерли 2,35 % участников, принимавших статины, и 2,8 %, не принимавших их: уменьшение на 16 % от частоты 2,8 % даёт частоту 2,35 %, и ЧБНЛ для предотвращения одного неблагоприятного исхода составляет 222 — довольно скромный показатель), а во-вторых, может быть преувеличено: например, в упомянутый кокрановский обзор не было включено исследование ALLHAT-LLT, охватившее 2867 пациентов, которое не обнаружило никакого снижения смертности при приёме правастатина. Вопросы также вызывало, что многие испытания не сообщали о каких-либо побочных действиях статинов, хотя о слабости и усталости при физической нагрузке на фоне их приёма упоминают многие обсервационные исследования; кроме того, отсутствие нежелательных явлений на фоне приёма лекарства вообще выглядит маловероятным. Проведённые впоследствии исследования подтвердили эффективность статинов для предотвращения сердечно-сосудистых заболеваний и относительно низкие риски развития нежелательных явлений, однако процесс уточнения показаний для их приёма продолжается: к примеру, рекомендации Европейского сообщества кардиологов от 2021 года значительно сузили показания к назначению статинов пациентам из стран с низким риском развития ССЗ.
Другим примером является эзетимиб — препарат, не относящийся к статинам, но тоже снижающий уровень холестерина липопротеинов низкой плотности. Регистрационные испытания показали, что приём препарата снижает уровень холестерина, однако, по данным более поздних испытаний, препарат не уменьшает риск развития атеросклероза, не снижает частоту сердечных приступов или смертности от болезней сердца и сосудов. Петер Гётше отмечал, что эзетимиб одобрен FDA в 2002 году по той лишь причине, что в клинических испытаниях снижал уровень холестерина низкой плотности на 15 %, и что продажи препарата высоки, хотя никому не известно, полезен он или вреден.
Противоречивы данные об эффективности при гриппе широко используемых для его профилактики и лечения препаратов — тамифлю (осельтамивира) и релензы (занамивира). Например, по данным метаанализа 2014 года, осельтамивир эффективен для профилактики гриппа на индивидуальном и домашнем уровнях. Однако кокрановский обзор 2014 года показал низкую эффективность при гриппе осельтамивира и занамивира: применение этих препаратов приводило лишь к небольшим преимуществам в облегчении симптомов гриппа, а именно сокращению продолжительности симптомов в среднем на полдня; в обзоре также подчёркивалось, что нет доказательств заметного снижения количества госпитализаций и серьёзных осложнений гриппа при приёме данных препаратов. Ещё в 2009 году систематический обзор и метаанализ, опубликованный в The Lancet Infectious Diseases, обнаружил низкую эффективность осельтамивира при лечении сезонного гриппа: оказалось, что препарат уменьшает продолжительность симптомов у здоровых пациентов (то есть у пациентов без других заболеваний) в среднем на 0,5 дня и на 0,74 дня у пациентов из группы риска, если лечение начато в первые часы после контакта с больным. Авторы метаанализа 2013 года пришли к выводу, что польза осельтамивира и занамивира для здоровых людей не перевешивает риски, а также что эти препараты не снижают риск осложнений у пациентов с факторами риска развития осложнений гриппа. Другой метаанализ того же года обнаружил, что осельтамивир не снижает риск госпитализации и тех или иных осложнений. Петер Гётше обвинял компанию Roche, производящую осельтамивир, в скрытии большей части данных её клинических испытаний действия препарата. Гётше указывает, что осельтамивир уменьшает продолжительность гриппа менее чем на сутки, чего можно добиться и с помощью куда более дешёвых препаратов, таких как аспирин и парацетамол, и что компания скрывала информацию о тяжёлых побочных действиях препарата «настолько глубоко, что исследователи из Кокрейновского Сотрудничества не имели возможности сообщить о них в своем кокрейновском обзоре».
См. также
Литература
На русском языке
На английском языке
Ссылки
| В библиографических каталогах |
|---|