
Опиоидные рецепторы
Опио́идные реце́пторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G белком. Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептиновые (ORL1) рецепторы. Они связываются как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах.
Содержание
История
К середине 1960-х годов, анализируя результаты фармакологических исследований, учёные стали предполагать, что опиоиды, вероятно, действуют на специфические рецепторы. Рецепторы были впервые определены как специфические молекулы при проведении исследований, в которых было обнаружено, что опиаты, меченные радиоизотопами, связываются с субклеточными фракциями головного мозга. Первое такое исследование было опубликовано в 1971 году с использованием 3H-леворфанола и его антагониста налоксона. В 1973 году, Кэндис Перт и Соломон Снайдер опубликовали результаты первого подробного радиоизотопного исследования опиоидных рецепторов с использованием 3H-налоксона. Это исследование было признано как первое точное обнаружение опиоидных рецепторов, хотя вскоре после него в этом же году были проведены два других подобных исследования. В 1976 году Мартин и коллеги по результатам исследований in vivo на собаках пришли к выводам о существовании нескольких типов опиоидных рецепторов. Для подтверждения их существования предпринимались попытки выделения очищенного белка опиоидных рецепторов, но они были безуспешными. В начале 1990-х годов, в молекулярно-биологических исследованиях выяснили структуру и механизм действия опиоидных рецепторов. Четыре различные кДНК были выделены как представители семейства опиоидных рецепторов. Три из них соответствуют µ-, δ- и κ-рецепторам, а четвёртая — новому типу рецепторов — ноцицептивным или ORL-1 (англ. opioid-receptor-like 1), который отнесён также к опиоидным, хотя он не обладает высоким сродством с опиоидными лигандами.:198
Механизм действия
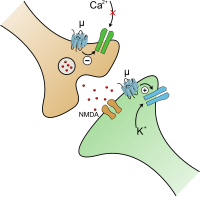
При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам.
Виды опиоидных рецепторов
В настоящее время различают четыре основные группы опиоидных рецепторов, каждая из которых подразделяется ещё на несколько подтипов:
| Рецептор | Подтип | Расположение | Функция |
|---|---|---|---|
| мю (μ) MOP |
μ1, μ2, μ3 |
|
μ1:
μ2:
μ3:
|
| дельта (δ) DOP |
δ1, δ2 |
|
|
| каппа (κ) KOP |
κ1, κ2, κ3 |
|
|
|
Ноцицептиновый рецептор NOP (ORL1) |
- |
|
|
Эффект анальгезии наблюдается при стимуляции μ-, δ- и κ-рецепторов. Агонисты μ-рецепторов, кроме того, вызывают угнетение дыхания и седативный эффект, а агонисты κ-рецепторов — психотомиметические эффекты. Действие большинства опиоидных анальгетиков связано со стимуляцией рецепторов μ-типа.
Номенклатура
Опиоидные рецепторы были названы по первой букве лиганда, с которым впервые обнаружена их связь. Так, морфин был первым веществом, у которого была обнаружена способность связываться с μ-рецепторами, а κ-рецепторы названы в честь обнаружения их связывания с кетоциклазоцином. Также рецептор с высоким сродством к энкефалинам был обнаружен в семявыносящих протоках мышей и назван δ-рецептором. Позднее другой опиоидный рецептор был обнаружен и клонирован на основе гомологичности с кДНК. Этот рецептор известен как ноцицептиновый рецептор или ORL 1-рецептор.
Предположено существование отдельных подтипов опиоидных рецепторов в тканях человека, однако исследователям пока не удалось получить генетических или молекулярных доказательств их существования и считают, что они возникают в результате посттрансляционной модификации клонированных типов рецепторов или димеризации.
Подкомитет IUPHAR допускает применение общепринятой греческой классификации, но рекомендует 3 классических рецептора (μ-, δ-, κ-) и ноцицептиновый рецептор обозначать как MOP, DOP, KOP и NOP соответственно.
Лиганды
Эндогенные
Эндогенные опиоидные пептиды вырабатываются в самом организме и реализуют свои опиоидные эффекты. Обнаружение опиоидных рецепторов привело к открытию их эндогенных лигандов. Вначале были обнаружены три семейства опиоидных рецепторов (эндорфины, энкефалины и динорфины) в различных областях ЦНС, желудочно-кишечном тракте и других периферических тканях.:200 Позднее были обнаружены ноцицептины, эндоморфины и другие опиоидные пептиды.:200 При этом эндорфины, эндоморфины проявляют максимальное сродство к рецепторам типа μ, энкефалины — типа δ, динорфины — типа κ:194
Экзогенные
Экзогенные опиоиды поступают в организм извне и связываются с опиоидными рецепторами. Первым открытым опиоидом был морфин, алкалоид опийного мака, выделенный Фридрихом Сертюрнером из опиума в 1804 г. В настоящее время известно большое количество соединений (как производных морфина, так и веществ другой структуры), являющихся лигандами к опиоидным рецепторам. По происхождению различают естественные, синтетические и полусинтетические опиоиды. Многие из них используются в медицине в качестве анальгетиков и средств против кашля.
Агонисты μ-опиоидных рецепторов обладают большим потенциалом злоупотребления, в краткосрочном периоде вызывая эйфорию, а при систематическом употреблении — сильную физическую и психическую зависимость. По этой причине оборот опиоидов в большинстве стран контролируется.
Некоторые экзогенные лиганды и их сродство к различным типам опиоидных рецепторов:
| Вещество | Сродство к рецепторам | ||
|---|---|---|---|
| μ | δ | κ | |
| Морфин | + + | + | + |
| Героин*, Метадон, Фентанил | + + | ||
| Сальвинорин А | + | ||
| Кодеин, Оксикодон, Гидрокодон, Декстропропоксифен | ± | ||
| Буторфанол | ± | + + | |
| Пентазоцин | ± | + | |
| Бупренорфин | ± | − − | − − |
| Налорфин | − | + | |
| Нальбуфин | − − | + + | |
| Налоксон и Налтрексон | − − | − | − |
| Обозначения: ++: сильный агонист, +: агонист, ±: частичный агонист, −: антагонист, − −: сильный антагонист. | |||
*Сам героин обладает довольно слабым сродством к μ-рецепторам, но легко проникает через гемато-энцефалический барьер, где преобразуется в 6-моноацетилморфин — мощный агонист μ-рецепторов.
Другие рецепторы
σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат.:198 Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.:125
Также предполагают существование других опиоидных рецепторов в связи с обнаружением эффектов эндогенных опиоидных пептидов, не опосредованных одним из четырёх известных опиоидных рецепторов. Только один из таких рецепторов был обнаружен и назван дзета (ζ-) опиоидным рецептором, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).
Предполагают существование эпсилон (ε-) опиоидного рецептора. Такое предположение появилось после того, как у бета-эндорфина были обнаружены эффекты, которые не опосредованы каким-либо известным опиоидным рецептором. Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням), а бупренорфин действует как антагонист этого рецептора. В настоящее время доступны несколько селективных агонистов и антагонистов предполагаемых ε-рецепторов, однако попытки обнаружить ген этих рецепторов были безуспешны.
Патология
A118G мутация (замена аденина на гуанин в экзоне 1), которая приводит к замещению аспарагина в позиции 40 на аспартат (N40D), наиболее частая мутация, приводящяя к изменению генного продукта µ-опиоидного рецептора человека. Предполагают, что пациентам с онкологическими заболеваниями, гомозиготным по A118G варианту, требуется более высокая доза морфина при длительном лечении болевого синдрома. Также внутривенное введение морфина, контролируемое пациентом, после тотальной гистерэктомии было значительно больше у женщин, гомозиготных по варианту A118G, чем у других пациенток. Некоторые формы мутаций δ-опиоидных рецепторов приводят к постоянной активации рецептора.
Литература
- Alan F. Schatzberg,Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — 1648 с. — ISBN 9781585623099.
- Bertram G. Katzung. Basic & clinical pharmacology. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057.
- Brian E. Leonard. Fundamentals of psychopharmacology. 3rd ed. — Wiley, 2003. — 527 с. — ISBN 0471521787.
|
Агонисты, частичные агонисты опиодных рецепторов |
|
||||||
|---|---|---|---|---|---|---|---|
| Агонисты-антагонисты смешанного действия |
|
||||||
| Антагонисты | |||||||
| Метаболиты опиоидов | |||||||
| Эндогенные лиганды | |||||||
| Прочие1 | |||||||
1 Соединения, родственные опиоидам, но не взаимодействующие или слабо взаимодействующие с опиоидными рецепторами
| |||||||
