
Молнупиравир
| Молнупиравир | |
|---|---|
 | |
| Химическое соединение | |
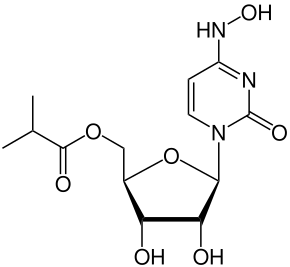
| ИЮПАК | ((2R,3S,4R,5R)-3,4-dihydroxy-5-(4-(hydroxyimino)-2-oxo-3,4-dihydropyrimidin-1(2H)-yl)tetrahydrofuran-2-yl)methyl isobutyrate |
| Брутто-формула | C13H19N3O7 |
| Молярная масса | 329.31 |
| CAS | 2349386-89-4 |
| PubChem | 145996610 |
| DrugBank | 15661 |
| Состав | |
| Другие названия | |
| Молнупиравир, Эсперавир | |
Молнупирави́р (коды разработки MK-4482 и EIDD-2801) — противовирусный препарат, активный при пероральном приёме. Подавляет репликацию некоторых РНК-вирусов. Используется для лечения COVID-19 у лиц, инфицированных SARS-CoV-2. Это пролекарство на основе синтетического нуклеозидного производного N4-гидроксицитидина (также известного как EIDD-1931) проявляет своё противовирусное действие за счёт внесения ошибок копирования во время репликации вирусной РНК.
Препарат был разработан для лечения гриппа в Университете Эмори университетской фармацевтической компанией Drug Innovation Ventures at Emory (DRIVE). Затем он был приобретён компанией Ridgeback Biotherapeutics из Майами, которая позже заключила соглашение с Merck & Co. для дальнейшей разработки препарата.
4 ноября 2021 Великобритания стала первой страной, одобрившей применение молнупиравира для лечения COVID-19.
Содержание
Механизм действия
Молнупиравир подавляет репродукцию вируса, способствуя распространению мутаций при репликации вирусной РНК с помощью РНК-направленной РНК-полимеразы. Он метаболизируется в аналог рибонуклеозида, напоминающий цитидин, β-D-N 4-гидроксицитидин 5'-трифосфат (также известный как 5'-трифосфат EIDD-1931 или NHC-TP). Во время репликации фермент вируса включает NHC-TP во вновь созданную РНК вместо использования настоящего цитидина.
Молнупиравир может переключаться между двумя формами (таутомерами), одна из которых имитирует цитидин (C), а другая — уридин (U). NHC-TP не распознается как ошибка проверяющими вирус ферментами экзонуклеазами, которые могут заменять мутантные нуклеотиды исправленными версиями. Когда вирусная РНК-полимераза пытается скопировать РНК, содержащую молнупиравир, она иногда интерпретирует его как C, а иногда как U. Это вызывает во всех последующих копиях больше мутаций, чем вирус может пережить — эффект, называемый катастрофой вирусной ошибки или летальным мутагенезом.

|

|
Синтез
Первый синтез молнупиравира был описан в патенте, поданном Университетом Эмори в 2018 году.
На первой стадии ацетон используется в качестве защитной группы, чтобы сделать две из трех гидроксильных групп уридина инертными по отношению к обработке ангидридом изомасляной кислоты, который превращает третью гидроксигруппу в ее сложный эфир. Обработка 1,2,4-триазолом и фосфорилхлоридом дает реакционноспособный промежуточный продукт, в котором часть триазола может быть заменена гидроксиламином. Наконец, удаление защитной группы с помощью муравьиной кислоты превращает материал в молнупиравир.
Были рассмотрены альтернативные запатентованные пути получения молнупиравира.
История разработки
Молнупиравир был разработан в Университете Эмори университетской фармацевтической инновационной компанией Drug Innovation Ventures at Emory (DRIVE). В 2014 году DRIVE начал скрининговый проект, финансируемый DTRA, с целью найти противовирусный препарат, нацеленный на вирус венесуэльского энцефалита лошадей (VEEV), что привело к открытию EIDD-1931. При превращении в пролекарство EIDD-2801 (молнупиравир) соединение также показало активность против других РНК-вирусов, включая грипп, лихорадку Эбола, чикунгунья и различные коронавирусы.
Безопасность
Жалоба, поданная в апреле 2020 года бывшим главой Управления перспективных биомедицинских исследований и разработок США (BARDA) Риком Брайтом, содержала обеспокоенность по поводу предоставления финансирования для дальнейшей разработки молнупиравира из-за аналогичных препаратов, обладающих мутагенными свойствами (вызывающих врождённые дефекты). Предыдущая компания, исследовавшая активный ингредиент препарата, Pharmasset, отказалась от него. Данные утверждения были опровергнуты Джорджем Пейнтером, генеральным директором DRIVE. Согласно его заявлению, были проведены исследования токсичности молнупиравира. Данные, предоставленные регулирующим органам в США и Великобритании, позволили продолжить исследования безопасности на людях весной 2020 года. DRIVE и Ridgeback Biotherapeutics также заявили, что планируют будущие исследования безопасности на животных. Мутагенные свойства молнупиравира были подтверждены с помощью HPRT-теста на клетках CHO-K1: было показано, что β-D-N 4-гидроксицитидин оказывает мутагенное действие на клетки дозозависимым образом (до 3 мкМ), предположительно, через соответствующую дезоксирибонуклеозидную форму.
COVID-19
После того, как в марте 2020 года было обнаружена активность молнупиравира в отношении SARS-CoV-2, препарат был протестирован в предварительном исследовании на предмет «Безопасности, переносимости и фармакокинетики» на здоровых добровольцах в Великобритании и США. В июне 2020 года Ridgeback Biotherapeutics объявила о переходе к фазе II исследований для проверки эффективности препарата в качестве средства лечения COVID-19. В июле в США и Великобритании были проведены два исследования на небольшом числе госпитализированных и не госпитализированных пациентов. В конце июля 2020 года, ещё не обнародовав никаких медицинских данных, компания Merck, сотрудничавшая с Ridgeback Biotherapeutics при разработке препарата, объявила о своём намерении начиная с сентября 2020 года перевести молнупиравир на позднюю стадию исследований. 19 октября 2020 года компания Merck начала исследование фаз 2/3, ориентированное на госпитализированных пациентов, которое продлится год.
3 декабря 2020 года в журнале Nature была опубликована статья о результатах исследования лечения молнупиравиром хорьков, инфицированных Covid-19. Исследование показало, что препарат был «эффективным» при пероральном введении инфицированным хорькам и что он блокировал передачу вируса между хорьками через 24 часа после приёма препарата.
1 октября 2021 года компания Merck заявила, что независимый консультативный совет, наблюдавший за ходом клинического исследования 2/3 фаз, рекомендовал досрочно прекратить исследование из-за убедительных доказательств пользы препарата для пациентов (снижение риска госпитализации или смерти примерно на 48%); согласно заявлению компании, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) согласилось с этим решением. Компания Merck планирует получить разрешение на использование в чрезвычайных ситуациях в США и подать заявки на регистрацию в регулирующие органы других стран. Компания также объявила о планах лицензировать препарат для производителей дженериков, чтобы ускорить его появление в продаже.
Согласно более позднему заявлению компании, эффективность против госпитализации составляет всё же не 48, а 30 процентов. Однако среди принимавших препарат погиб всего один пациент, а среди принимавших плацебо — девять.
Клинические исследования препарата проходят также и на Украине.
Регистрация и доступность
В июне 2021 года Министерство здравоохранения и социальных служб США обязалось закупить молнупиравир на сумму 1,2 миллиарда долларов США (соответствует примерно 1,7 миллионам полных курсов препарата) у производителя, компании Merck, если препарат получит разрешение на экстренное использование (EUA) или одобрение Управления по контролю за продуктами и лекарствами США (FDA).
В октябре 2021 года Комитет по лекарственным средствам человека (CHMP) Европейского агентства по лекарственным средствам (EMA) начал непрерывный обзор молнупиравира.
В ноябре 2021 года молнупиравир был одобрен в Великобритании Агентством по регулированию лекарственных средств и товаров медицинского назначения (MHRA) для лечения подтвержденных инфекций COVID-19. MHRA выдало условное разрешение на продажу, действительное в Соединенном Королевстве, и разрешение на использование в чрезвычайных ситуациях для Северной Ирландии. Согласно соглашению, подписанному в октябре, Великобритания рассчитывает получить 480 000 доз молнупиравира в этом году.
Австралия закупила 300 000 курсов. В октябре 2021 года новозеландский фармацевтический поставщик Pharmac закупил 60 000 доз.
В ноябре 2021 года Генеральное управление по лекарственным средствам Бангладеш (DGDA) утвердило разрешение на продажу молнупиравира, производимого Beximco Pharmaceuticals и Eskayef Pharmaceuticals под торговыми марками Emorivir и Monuvir соответственно. Beximco стала первым производителем, выпустившим непатентованную версию (дженерик) таблеток молнупиравира. Стоимость полного курса дженерика составит 33$. Для сравнения, правительство США закупает препарат по цене 700$ за курс.
Разрешен к применению в США 23 декабря 2021 года.
В России производство молнупиравира по лицензии планируется компанией Р-Фарм. Дженерик молнупиравира зарегистрирован в России под торговым названием Эсперавир, выпускается группой компаний «Промомед» на заводе АО «Биохимик» в капсулах по 200 и 400 мг.
См. также
|
Противовирусные препараты для системного применения — АТХ-
| ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Согласно классификации АТХ
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Другие не классифицированные препараты | ||||||||||||||||||||||||||

