
Генетически модифицированная пища

Генетически модифицированная пища — продукты питания, полученные из генетически модифицированных организмов (ГМО) — растений или животных. Продукты, которые получены при помощи генетически модифицированных организмов, включая микроорганизмы, или в состав которых входит хоть один компонент, полученный из продуктов, содержащих ГМО, также могут считаться генетически модифицированными, в зависимости от законодательства конкретной страны.
Существует научный консенсус, что имеющиеся в настоящее время продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания.
На 2015 год генно-модифицированные растения выращивались в 28 странах, на рынок было допущено 28 генно-модифицированных сельскохозяйственных культур (включая как пищевые, так и кормовые и технические). В 2015 году впервые было разрешено к продаже в пищу генетически модифицированное животное — атлантический лосось AquAdvantage. Генетически модифицированные микроорганизмы используются при производстве значительного количества сыров, а также при производстве йогуртов.
Содержание
- 1 Методы получения
- 2 Цель генетического модифицирования
- 3 Использование
- 4 Способы проверки на наличие ГМО
- 5 Путь к коммерциализации
- 6 Риски, связанные с ГМ продуктами питания
- 7 Регулирование допуска, торговли и маркировки ГМ-продуктов питания
- 8 См. также
- 9 Примечания
- 10 Литература
- 11 Ссылки
Методы получения
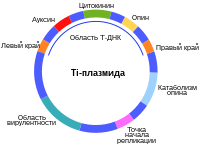
Генетически модифицированные организмы получают новые свойства как правило благодаря переносу в геном новых генов. Новые гены могут быть взяты из генома родственных видов (цисгенез) или, теоретически, из любого организма (в случае трансгенеза).
Генетически модифицированные организмы получают методом трансформации при помощи одного из способов: агробактериальный перенос, баллистическая трансформация, электропорация или вирусная трансформация. Большая часть коммерческих трансгенных растений получена при помощи агробактериального переноса или баллистической трансформацией. Обычно для переноса используют плазмиду, содержащую ген, работа которого придаёт организму заданные свойства, промотор, который регулирует включение этого гена, терминатор транскрипции, а также кассету, которая содержит селективный ген стойкости к антибиотику канамицину или гербициду. Получение трансгенных сортов нового поколения не предусматривает использование селективного гена, побочные качества которого могут рассматриваться как нежелательные. Зато генетическая конструкция может нести несколько генов, которые необходимы для комплексной работы генетической конструкции.
Цель генетического модифицирования
Генетическая модификация может давать организму и пищевому продукту, который производится из него, ряд новых свойств. Большинство культивируемых генно-модифицированных растений обладают устойчивостью к насекомым-вредителям или к гербицидам. В результате снижаются затраты на выращивание. Другими свойствами, полученными в результате генной модификации пищевых культур, являются ускорение роста, улучшение пищевых и технологических свойств продуктов, устойчивость к неблагоприятным условиям, устойчивость к возбудителям болезни, таким как вирусы и грибы.
Ряд сортов содержит более одного дополнительного гена, например кукуруза, одобренная в 2017 году, содержит 3 гена, обеспечивающих возможность обработки её гербицидами глифосат, 2-4-D и глюфозинат, а также 6 генов, отвечающих за выработку Bt-токсинов и 1 для уничтожения кукурузного жука.
Устойчивость к гербицидам
Большинство гербицидов действуют избирательно против нежелательных видов растений. Кроме этого, существуют гербициды широкого спектра действия, которые влияют на обмен веществ практически всех видов растений, как например глифосат, глюфозинат аммония или имидазолин.
Механизм действия глифосата заключается в том, что он ингибирует фермент 5-енолпирувил-шикимат-3-фосфат-синтазу, участвующую в синтезе важных аминокислот. Благодаря переносу формы гена 5-енолпируват-шикимат-З-фосфатсинтазы (CP4 EPSPS) из грунтовой бактерии Agrobacterium tumefaciens удалось придать признаки устойчивости к глифосату. Однако механизм устойчивости обусловлен связыванием глифосата ферментом. Поэтому в отличие от селекционных сортов гм-соя накапливает глифосат.
Перенос гена фосфинотрицин-N-ацетилтрансферазы (PAT) из бактерии Streptomyces viridochromogenes обеспечил трансгенным растениям стойкость к гербициду глюфозинат аммония (коммерческое название производителя Bayer — «Либерти»).
Существуют также сорта, устойчивые к гербициду 2,4-D за счёт вставки синтетической формы гена бактерии Sphingobium herbicidovorans.
В 2008 году выращивание трансгенных растений со стойкостью к гербицидам занимало первое место в общем количестве всех выращенных трансгенных растений и составило 63 % или 79 млн из 125 млн гектаров, засеянных трансгенными растениями в мире. Подсчитано, что только выращивание трансгенной сои с устойчивостью к гербицидам с 1996 по 2007 года привело к кумулятивному уменьшению использования общего количества гербицидов на 73 тысячи тонн (4,6 %). Однако использование устойчивых к гербицидам культур в итоге привело к росту применения глифосата и других гербицидов из-за появления устойчивых к гербицидам сорняков.
В 2009 году стойкие к гербицидам растения потеснили сорта, устойчивые к насекомым-вредителям и несущие сразу два или три встроенных признака.
По состоянию на 2016 год выращивание устойчивых к гербицидам культур (в первую очередь устойчивых к глифосату) привело к увеличению объёмов использования гербицидов в результате появления устойчивых к глифосату сорных растений.
Устойчивость к насекомым
Инсектициды на основе бактериального Bt-токсина использовались в сельском хозяйстве с конца 1930-х годов. В органическом земледелии распространено использование бактериальной суспензии Bacillus thuringiensis для борьбы с насекомыми.
Перенесённый в геном растения бактериальный ген cry Bt-токсинов придаёт растению устойчивость против ряда насекомых-вредителей. Самые распространённые растения, в которые встраивают ген Bt-токсина — кукуруза (например, линия MON810 производства Монсанто) и хлопчатник, разработанный и предложенный Монсанто в 1996 году. Существует ряд сортов картофеля с Bt-токсинами.
Недостатком метода является то, что инсектицид присутствует в растении перманентно, что делает невозможным его дозировку. Кроме того, в трансгенных сортах первого поколения ген экспрессируется под конститутивным промотором, поэтому продукт его гена присутствует во всех частях растения, даже в тех, которые насекомыми не поражаются. Для решения этой проблемы разрабатываются генетические конструкции под контролем специфических промоторов. В 2009 году трансгенные Bt-растения были самыми распространёнными по количеству культивированных трансгенных растений.
Устойчивость к вирусам
Вирусы вызывают целый ряд заболеваний растений и их распространение тяжело контролировать, способов химической защиты тоже не существует. Самыми эффективными способами борьбы считаются севооборот и селекция стойких сортов. Генетическая инженерия рассматривается как перспективная технология в разработке стойких сортов растений. Самая распространённая стратегия — косупрессия, то есть перенос в растение гена вируса, который кодирует белок его оболочки. Растение производит вирусный белок до того, как вирус в него проникнет, что стимулирует включение защитных механизмов, которые блокируют размножение вируса, в случае его проникновения в растение.
Впервые эту стратегию использовали для спасения папайной индустрии на Гавайях от вируса кольцевой папайной пятнистости. Впервые вирус был идентифицирован в 1940 году, а в 1994 он быстро распространился, в результате чего индустрия оказалась на грани полного уничтожения. В 1990 году начались интенсивные работы по трансформации папайи, которые в 1991 году увенчались успехом. Первые плоды коммерческого сорта папайи «Rainbow» были собраны в 1999 году.
Устойчивость к грибам
Разрабатываемые модификации
Гриб Phytophthora infestans принадлежит к группе растительных паразитов, вызывающих фитофтороз, наносящий значительные убытки при культивировании картофеля и томатов.
Компания BASF разработала генно-модифицированный сорт картофеля «Fortuna», в который перенесли два гена устойчивости к фитофторозу (Rpi-blb1 и Rpi-blb2) из южно-американского дикого сорта картофеля Solanum bulbocastanum. В 2006 году сорт прошёл успешное полевое испытание в Швеции, Нидерландах, Великобритании, Германии и Ирландии.
Устойчивость к засухе
Недостаток влаги вследствие изменения климата или отдельных засушливых периодов приводит к заметной потере урожая, особенно в регионах с неблагоприятными условиями выращивания. Биотехнология ищет возможности для искусственной защиты растений от засухи. Например, ген cspB из особых штаммов бактерии Bacillus subtilis, устойчивых к замерзанию, также придаёт организму растения качество устойчивости к засухе. Компании BASF и Monsanto разработали сорта кукурузы, которые по данным производителей в полевых исследованиях при неблагоприятных засушливых условиях давали урожайность на 6,7-13,4 % больше, чем конвенционные сорта. Заявка на допуск подана в соответствующие инстанции стран Северной Америки, Европейского союза и Колумбии. Также эти сорта планируется привлечь к программе Water Efficient Maize for Africa с 2015 до 2017 года
Устойчивость к солям и алюминию
Засоление грунтов — одна из важных проблем сельскохозяйственного растениеводства. В мире около 60 млн гектаров полей имеют такие изъяны, что делает невозможным их эффективное использование. Способами генной модификации удалось получить рапс, несущий ген ионного транспортера AtNHX1 из арабидопсиса, который делает его стойким к засолению хлоридом натрия до 200 мМоль/л.
В кислых грунтах создаются благоприятные условия для освобождения из алюминиевых силикатов трёхвалентных ионов алюминия, которые для растений токсичны. Кислые грунты составляют до 40 % плодородных земель, что делает их непригодными для культивирования. Устойчивость к алюминию пробовали сконструировать искусственно, путём переноса в растения рапса гена митохондриальной цитрат-синтазы из арабидопсиса.
Модификация пищевых и технологических свойств продукта
Существующие модификации
- Повышенная выработка лизина
В растительной клетчатке синтез определённых аминокислот прекращается, если их концентрация достигла определённого уровня. Генно-инженерными методами в растение кукурузы перенесли бактериальный ген cordapA из Corynebacterium glutamicum под контролем семенного промотора Glb1. Этот ген кодирует фермент лизин-нечувствительную дигидропиколинат-синтазу, которая не распознается растительными системами обратного ингибирования. Кукурузы линии LY038, разработанная компанией Монсанто, содержит увеличенное количество аминокислоты лизина, и поэтому более питательная в качестве корма для животных. Линия кукурузы LY038 коммерческая и допущена к культивированию в Австралии, Канаде, Японии, Мексике, Филиппинах и США. В Европе запрос на культивирование был подан в Нидерландах, разрешение получено в 2007 году, но в 2009 году разрешение было отозвано.
- Подавление синтеза амилозы
Клубни картофеля содержат крахмал, находящийся в двух формах: амилоза (20-30 %) и амилопектин (70-80 %), каждая из которых имеет свои химические и физические особенности. Амилопектин состоит из больших разветвлённых молекул полисахаридов, а молекулы амилозы состоят из неразветвленных молекул. Амилопектин растворим в воде и его физические свойства больше подходят для использования в бумажной и химической промышленностях. Как правило, в производственные технологии заложены дополнительные шаги по разделению или модифицированию амилозы и амилопектин химическим, физическим или ферментативным путём.
Кампания BASF разработала технический сорт картофеля «Amflora», в котором генно-инженерным путём исключен ген грануло-связанной крахмал-синтазы, которая способствует синтезу амилозы. Такой картофель накапливает в клубнях исключительно амилопектин, а поэтому технологически больше приспособлен к обработке.
Сорт «Amflora» получил допуск Европейского Союза и в 2010 году планируется засадить 20 гектаров в Германии, 80 гектаров в Швеции и 150 гектаров в Чехии.
Разрабатываемые модификации
- Изменение композиции жиров и жирных кислот
Использование незаменимых жирных кислот является важным условием для предотвращения пренатальных и неонатальных изъянов в развитии, поскольку они необходимы для нормального развития богатых молекулярными мембранами тканей головного мозга, нервной и кровеносной систем. Полинасыщенные жирные кислоты с углеродной цепочкой более 16 атомов находятся в основном в животных клетках. К примеру, докозагексаеновая кислота в человеческом теле не синтезируется и должна поступать в организм с едой. Производство незаменимых жирных кислот рассматривается пищевой индустрией как новый и дешёвый источник питательных пищевых компонентов.
В семенах рапса в обычных условиях не присутствуют такие жирные кислоты, как арахидоновая, эйкозопентаеновая и докозагексаеновая кислота. Зато семена близкого азиатского родственника рапса — коричневой горчицы Brassica juncea содержат линолевую и линоленовую кислоты, которые могут быть превращены за три последовательных биохимических реакции в арахидоновую и эйкозопентаеновую кислоты. Созданы трансгенные линии коричневой горчицы, в которые перенесены целые блоки (от трёх до девяти генов, которые кодируют ферменты для превращения линолевой и линоленовой кислот в арахидоновую, эйкозопентаеновую и докозагексаеновую кислоты).
Хотя урожайность этих растений, как и раньше, низкая, эти эксперименты показывают, что в принципе возможно превращение липидного метаболизма так, чтобы полиненасыщенные жирные кислоты продуцировались в масляных культурах.
- Уменьшение аллергенности и детоксикация
Значительная часть людей имеет аллергию на определённые продукты питания. Аллерген соевых бобов особо проблематичный, поскольку соевые продукты находят все более широкое использование в производстве продуктов питания в связи с высокой питательной ценностью соевых белков. Это означает, что людям с аллергией на сою все сложнее получить неаллергенные продукты питания. Кроме того, у свиней и телят, употребляющих соевые корма, также наблюдаются аллергические реакции. Пищевыми аллергенами почти всегда являются природные белки. Одним из высокоаллергенных белков семян сои является Gly-m-Bd-30-K, который составляет около 1 % от общего белка семян. Именно на этот белок реагируют больше чем 65 % аллергиков. Возможно заблокировать ген этого белка и разработать линии сои, которые не будут содержать этот аллерген.
Урожай хлопчатника на каждый килограмм волокна даёт близко 1,6 кг семян, которые содержат около 20 % масла. После соевых бобов хлопчатник является вторым по количеству источником масла, пищевое применение которого ограничено высоким содержанием госсипола и других терпеноидов. Госсипол токсичен для сердца, печени, репродуктивной системы. Теоретически 44 мегатонны семян хлопчатника ежегодно могли бы обеспечить потребность в масле для 500 млн людей. Конвенционными методами возможно получить хлопчатник без госсипола, но в этом случае растение остается без защиты от насекомых-вредителей. Генно-инженерными методами возможно целенаправленно прервать в семенах один из первых шагов биохимического синтеза госсипола. В этом случае содержание госсипола в семенах уменьшается на 99 %, а остальные органы растения продолжают его продуцировать, что защищает растение от насекомых.
Уменьшение аллергенности и детоксикация генно-инженерными способами находятся на стадии научных разработок.
Использование
В начале 1988 года в Ирландии начали эксперименты по изменению генетической структуры лососей (с целью повышения продуктивности этих рыб в икринки лосося внедрили копии гена, кодирующего выработку ростового гормона).
Впервые генно-модифицированные продукты появились на рынке в начале 1990-х годов. В 1994 коммерциализирован генетически модифицированный томат (Flavr Savr), продукции компании Calgene с повышенным сроком хранения. Генетическая трансформация в этом случае не приводила к встраиванию какого-либо гена, а касалась исключительно удаления гена полигалактуроназы при помощи антисенс-технологии. В норме продукт этого гена способствует разрушению клеточных стенок плода в процессе хранения. «Flavr Savr» недолго просуществовал на рынке, поскольку существуют более дешевые конвенционные сорта с такими же свойствами.
Подавляющая часть современных генно-модифицированных продуктов растительного происхождения. По состоянию на 2015 год было коммерциализировано и допущено к выращиванию как минимум в одной стране 28 вида трансгенных растений (не считая ГМ-цветы). Для употребления в пищу человеком разрешеныкартофель, папайя, тыква, баклажаны, яблоки, кукуруза, соя, фасоль, цуккини, дыня, рис, помидоры, сладкий перец, пшеница. Для переработки в пищевые продукты, такие как сахар, крахмал, растительное масло, используются сахарная свёкла и сахарный тростник, кукуруза, соя, рапс.
В 2015 году впервые было разрешено к продаже в пищу генетически модифицированное животное: атлантический лосось AquAdvantage (англ. AquAdvantage salmon) был одобрен FDA для продажи в США.
Некоторые пищевые продукты (йогурты, биологически активные добавки, ферментные препараты) могут содержать живые либо нежизнеспособные генетически модифицированные микроорганизмы (ГММ). К генетически модифицированной пище могут быть отнесены и продукты, содержащие компоненты, полученные с использованием ГММ, например, сыры, производимые с использованием сычужного фермента от генно-модифицированых бактерий (по такой технологии производится более 50 % твердых сыров).
Сельскохозяйственные культуры
Состояние на 2009 год
По состоянию на 2009 год было коммерциализировано и допущено к выращиванию как минимум в одной стране 33 вида трансгенных растений: соя — 1, кукуруза — 9, рапс — 4, хлопчатник — 12, сахарная свёкла — 1, папайя — 2, тыква — 1, паприка — 1, томат — 1, рис — 1[уточнить].
Всего в мире были засеяны генетически модифицированными растениями (как пищевыми, так и кормовыми и техническими культурами) 134 млн гектар. Это соответствовало 9 % всех культивированных плодородных земель (1,5 млрд га). ГМ-культуры официально культивировались в 25 странах. Кроме этого, импорт пищевых и кормовых ГМ-культур 24 видов был разрешен в 32 странах, не выращивающих такие культуры самостоятельно.
Состояние на 2015 год
Площади, занятые ГМ-культурами (как пищевыми, так и кормовыми и техническими) выросли до 180 млн гектаров. Это соответствовало 12 % всех пашен, 1,5 млрд га.
Генно-модифицированные растения выращиваются в 28 странах, особенно широко — в США, Бразилии, Аргентине, Канаде, Индии. Начиная с 2012 года, производство ГМ-сортов развивающимися странами превышает производство в промышленно развитых государствах. Из 18 миллионов фермерских хозяйств, выращивающих ГМ-культуры, более 90 % приходилось на малые хозяйства в развивающихся странах.
Наибольшие площади были заняты ГМ-культурами в следующих странах:
| Ранг | Страна | Площадь, млн га | Культура |
|---|---|---|---|
| 1 | США | 70,9 | Кукуруза, соя, хлопчатник, рапс, сахарная свёкла, люцерна, папайя, тыква, картофель |
| 2 | Бразилия | 44,2 | Соя, кукуруза, хлопчатник |
| 3 | Аргентина | 24,5 | Соя, кукуруза, хлопчатник |
| 4 | Индия | 11,6 | Хлопчатник |
| 5 | Канада | 11,0 | Рапс, кукуруза, соя, сахарная свёкла |
| 6 | Китай | 3,7 | Хлопчатник, папайя, паприка |
| 7 | Парагвай | 3,6 | Соя, кукуруза, хлопчатник |
| 8 | Пакистан | 2,9 | Хлопчатник |
| 9 | ЮАР | 2,3 | Кукуруза, соя, хлопчатник |
| 10 | Уругвай | 1,4 | Соя, кукуруза |
К концу 2015 года в 40 странах, регулирующих использование ГМ-культур, было выдано 3 418 разрешений на использование таких культур для употребления в пищу, на корм скоту и для технических целей. Всего на рынок было допущено 28 ГМ-культур (363 сортов), не считая ГМ-цветы. В следующие пять лет ожидалось получение разрешений на 85 новых сортов ГМ-культур. Основными культурами являлись: соя, кукуруза, хлопок и рапс. Значительное количество разрешений было также выдано на ГМ-картофель. Генно-модифицированная соя занимала более чем 4/5 (83 %, 92 млн га) от всей площади под соей в мире. Трансгенный хлопчатник занимал 75 % от всей площади под хлопчатником, кукуруза — 29 % от площадей под кукурузой, рапс — 24 %. Наиболее популярные изменения генома относились к устойчивости к гербицидам и к борьбе с насекомыми (в том числе оба изменения сразу).
Способы проверки на наличие ГМО
Как правило, проверка на наличие ГМО проводится при помощи полимеразной цепной реакции (ПЦР). Такой тест предусматривает три основных действия:
- Пробоподготовка, состоящая в выделении ДНК из тестируемого пищевого продукта;
- Постановка ПЦР с выделенной ДНК и с парой праймеров, которые комплементарны участку встроенного гена. Иногда один из праймеров может быть комплементарен пограничному участку между хромосомной ДНК «хозяина» и встроенной ДНК. В ходе ПЦР многократно амплифицируется участок ДНК, специфичный для встроенного гена или для события-вставки.
- Выявление амплифицированного ПЦР-продукта при помощи разных устройств. Если продукт обнаруживается, это является свидетельством, что в пробе выявлена ДНК генно-модифицированного организма.
Количественное определение на наличие ГМО: точное количество ГМО в продукте определить невозможно. Долгое время определялось только наличие ГМО в продукте: содержит продукт ГМО или нет. Относительно недавно были разработаны способы количественного определения — ПЦР в режиме реального времени, когда амплифицированный продукт помечается флуоресцентным красителем и интенсивность излучения сравнивается с откалиброванными стандартами. Однако, даже самые лучшие устройства все ещё имеют значительную погрешность.
Количественное определение на наличие ГМО возможно только тогда, когда из продукта можно выделить достаточное количество ДНК. Если возникают трудности с выделением ДНК, которая довольно неустойчивая, разрушается и теряется в процессе обработки продукта (очищение и рафинирование масла или лецитина, термическая и химическая обработка, обработка давлением), тогда количественное определение невозможно. Способы выделения ДНК в разных лабораториях могут быть разными, поэтому показатели количественного значения могут так же различаться, даже если исследуется один и тот же продукт.
Независимо от того, качественное или количественное определение используется для анализа пищевых продуктов на содержание ГМО, недостатком способа является большое количество ложноположительных и ложноотрицательных результатов. Самые точные результаты можно получить при анализе необработанного растительного сырья.
Для качественного определения содержания ГМО иногда используют стандартизированные проверочные чип-системы. Способы определения ДНК в разных лабораториях могут отличатся, поэтому различаться могут и показатели количественного значения, даже если анализируется один и тот же продукт. В основе чип-систем лежит принцип комплементарной гибридизации ДНК с меткой, нанесённой на чип. Ограничивающим фактором этого способа является так же эффективное выделение ДНК. Однако подобные проверочные системы не охватывают всего разнообразия ГМО и сложны их определения.
Путь к коммерциализации
В каждой стране путь к коммерциализации ГМО разный. Допуск к продаже и культивированию предусматривает разные процедуры, однако они основаны на одинаковых принципах.
Безопасность: продукт должен быть безопасным и не представлять угрозы здоровью людей или животных. Также он должен быть безопасным для окружающей среды. Безопасность определяется согласно разработанным испытаниям, которые основываются на новейших научных знаниях и применяются с использованием современных технологических средств. Если продукт не подходит под вышеозначенные требования — он не получает разрешения на культивирование или распространение. Если с течением времени в продукте выявляются опасные свойства, он исключается с рынка.
Право выбора: даже если ГМО получает разрешение на культивирование или распространение, потребители, фермеры и предпринимательство должны иметь право выбора — использовать его или нет. Это означает, что в перспективе должна существовать возможность производить продукцию без использования генной инженерии.
Обеспечение принципа права выбора возможно при условии соблюдения двух правил:
Маркировка: самый важный способ для обеспечения права выбора. Где бы и каким образом ГМО не использовали, он должен быть ясно промаркирован. В таком случае потребитель имеет возможность сделать осознанный выбор.
Отслеживание: маркировка так же необходима, даже если ГМО нельзя отследить в остаточном продукте. Это касается производителей и поставщиков продуктов. В этом случае они обязуются информировать потребителей путём выдачи ответственной документации относительно сырья.
Допуск для одной генно-модифицированной культуры в одной стране оценивается от 6 до 15 млн долларов США, сюда включены затраты на приготовление запроса, оценка молекулярных характеристик, состава и токсичности продукта, исследования на животных, характеристика белков на аллергенность, оценка агрономических качеств, разработка способов испытания, подготовка юридических документов для организации экспорта. Затраты оплачивает лицо, подающее запрос на допуск.
Риски, связанные с ГМ продуктами питания
Риск для здоровья
Установить 100%-ю безопасность любых пищевых продуктов научно невозможно. Однако генетически-модифицированные продукты проходят подробные исследования, которые базируются на современных научных знаниях.
Не было зарегистрировано никаких сообщений о вредных эффектах в человеческой популяции от генетически модифицированных продуктов питания.
Существует научный консенсус, что имеющиеся в настоящее время продукты питания, полученные из ГМ-культур, не представляют большего риска для здоровья человека, чем обычные продукты питания, но каждый ГМ-продукт необходимо тестировать в каждом конкретном случае до его введения.
Пищевые аллергии, которые могут быть связаны с ГМО
У присутствующих сегодня на рынке таких продуктов не было обнаружено аллергических эффектов.
Одним из возможных рисков употребления генетически модифицированной еды рассматривается её потенциальная аллергенность. Когда в геном растения встраивают новый ген, конечным результатом является синтез в растении нового белка, который может быть новым в диете. В связи с этим невозможно определить аллергенность продукта, базируясь на прошлом опыте. Теоретически каждый протеин — потенциальный триггер аллергической реакции, если на его поверхности есть специфические места связи к антителу IgE. Антитела, являющиеся специфическими для конкретного антигена, производятся в организме индивидуума, чувствительного к аллергену. Чувствительность к аллергенам часто зависит от генетической предрасположенности, поэтому расчёты аллергического потенциала невозможно сделать с 100%-й точностью. Новые потенциальные аллергены формируются так же в сортах конвенционной селекции, но отследить подобные аллергены очень сложно, кроме того процедура допуска конвенционных сортов к анализу на аллергенность не предусматривается.
Каждый генно-модифицированный сорт, перед тем как попасть к потребителю, проходит процедуру оценки его аллергенного потенциала. Тесты предусматривают сравнение белковой последовательности с известными аллергенами, стабильность белка во время переваривания, тесты при помощи крови от чувствительных к аллергенам индивидуумов, тесты на животных.
В случае, если продукт в процессе разработки демонстрирует аллергические свойства, запрос на коммерциализацию может быть отозван. Например, в 1995 году компания Pioneer Hi-Bred разрабатывала кормовую сою с повышенным содержанием аминокислоты метионина. Для этого использовали ген бразильского ореха, который, как со временем выяснилось, демонстрировал аллергические качества. Разработка продукта остановлена, поскольку есть риск, что кормовая соя может случайно или в результате недобросовестных действий поставщика попасть на стол к потребителю.
Другой пример потенциально-аллергенного продукта — кормовой сорт Bt-кукурузы «StarLink», разработанный Aventis Crop Sciences. Регулирующие органы США разрешили продажу семян «StarLink» с предостережением, что культура не должна использоваться для употребления человеком. Ограничение базировалось на тестах, которые продемонстрировали плохие пищеварительные качества белка. Несмотря на ограничение, семена кукурузы «StarLink» были найдены в продуктах питания. 28 человек обратились в медицинские учреждения с подозрением на аллергическую реакцию. Однако в центре контроля за заболеваниями США изучили кровь этих людей и пришли к выводу, что нет никаких доказательств повышенной чувствительности к белку Bt-кукурузы «StarLink». С 2001 года культивирование сорта прекращено. Мониторинг продемонстрировал, что с 2004 года никаких следов культивирования сорта не наблюдается.
В 2005 году австралийская компания CSIRO разработала пастбищный горох путём встраивания в него гена устойчивости к насекомым-вредителям, выделенного из фасоли. Экспериментальные исследования показали аллергические поражения лёгких у мышей. Дальнейшая разработка этого сорта была немедленно прекращена. При этом аллергическая реакция была предположительно связана с тем, что белок, синтезировавшийся в горохе, был не идентичен белку, который синтезировала фасоль, в связи с пострансляционной модификацией. Эксперименты 2013 года, проведённые другими исследователями, показали что аллергические реакции у некоторых видов мышей вызывали как трансгенные виды бобовых, так и нетрансгенная фасоль.
Токсичность, которая может быть связана с ГМО
Отдельные продукты генов, которые переносятся в организм генно-инженерными методами, могут быть вредными. В 1999 году опубликована статья Арпада Пустай (Árpád Pusztai), касающаяся токсичности генно-модифицированного картофеля для крыс. В картофель был встроен ген лектина из подснежника Galanthus nivalis с целью повысить стойкость картофеля к нематодам. Скармливание картофеля крысам продемонстрировало токсический эффект генно-модифицированного сорта. Опубликованию данных предшествовал громкий скандал, поскольку результаты были представлены до экспертной оценки другими учёными. Предложенное Пустаем объяснение, что токсический эффект, скорее всего, вызвал не лектин, а способ переноса гена, не поддерживается большинством учёных, поскольку представленных в статье данных недостаточно для формулирования именно таких выводов. Разработка трансгенного картофеля с геном лектина прекращена.
Современная методология допуска трансгенных растений к использованию предусматривает химический анализ состава в сравнении с конвенционными продуктами и исследования на подопытных животных. Отдельным предметом дискуссии является дизайн экспериментов на животных. Российский исследователь Ирина Ермакова провела исследование на крысах, которое, по её мнению, демонстрирует патологическое влияние генно-модифицированной сои на репродуктивные качества животных. Поскольку данные широко обсуждались в мировой прессе, не будучи опубликованными в реферированных журналах, научная общественность рассмотрела результаты более тщательно. Обзор шести независимых экспертов мирового уровня привёл к следующим выводам относительно этого опыта:
- Результаты Ирины Ермаковой противоречат стандартизированным результатам других исследователей, которые работали с тем же самым сортом сои и не выявили токсического влияния на организм.
- В своей работе Ермакова отметила, что получила трансгенную сою из Нидерландов, хотя отмеченная фирма не поставляет генно-модифицированную сою.
- Использованные ГМО-продукты и контрольные образцы являются смесью оригинальных сортов.
- Не было приведено доказательств, что контрольные образцы не содержат материал с модифицированными генами, также не показано, что модифицированная соя на 100 % трансгенная.
- Отсутствует описание диет и составляющих рациона крыс.
- Отсутствуют данные относительно питания отдельных особей, продемонстрированные данные касаются только групп особей.
- Смертность в контрольной группе значительно превышала нормальную смертность крыс этой лабораторной линии. Также сниженный вес в контрольной группе указывает на недостаточный досмотр или недостаточное питание крыс, которое делает выводы исследователя нерелевантными.
В 2009 году опубликованы исследования Эрика Сералини, касающиеся оценки токсического влияния трансгенных сортов кукурузы NK 603, MON 810, MON 863 на здоровье крыс. Авторы пересчитали собственными статистическими методами результаты кормления крыс, полученные «Монсанто» для сортов NK 603 и MON 810 в 2000 году и Covance Laboratories Inc для сорта MON 863 в 2001 году. Выводы свидетельствуют о гепатотоксичности употребления этих генно-модифицированных сортов, и поэтому привлекли пристальное внимание контролирующих органов.
EFSA GMO Panel выдвинула ряд критических замечаний к выбранному статистическому методу вычисления и выводам, приведённых в статье:
- Результаты представлены исключительно в виде процента отличий для каждой переменной, а не в их фактически измеряемых единицах.
- Рассчитанные значения параметров токсикологических испытаний не связаны с диапазоном нормального распределения для исследуемых видов.
- Рассчитанные значения токсикологических параметров не сравнивались с нормальным распределением у подопытных животных, которые кормились разными рационами.
- Статистически достоверные отличия не связаны с дозами.
- Несоответствия между статистическими аргументами Сералини и результатами этих трёх исследований кормления животных, связанные с патологией органов, гистопатологией и гистохимией.
EFSA пришли к выводу, что результаты, продемонстрированные Сералини, не дают оснований для пересмотра предыдущих выводов про безопасность пищевых продуктов, полученных для трансгенных сортов кукурузы NK 603, MON 810 та MON 863.
Вышедший в 2013 году обзор 1783 исследований, сделанных в период с 2003 по 2013 год и затрагивавших разные аспекты безопасности ГМ-культур, делает вывод об отсутствии научных свидетельств токсичности ГМ-культур.
Исследование Жиля-Эрика Сералини о вреде ГМО-кукурузы в 2012 году
В 2012 году Сералини опубликовал в журнале «Food and Chemical Toxicology» статью, в которой приводились результаты исследований долгосрочного влияния питания ГМ-кукурузой, устойчивой к раундапу, на крыс. В статье утверждалось, что крысы, которые питались ГМ-кукурузой, чаще были подвержены заболеванию раком. Публикация вызвала очень серьёзную критику. Перед публикацией Сералини созвал пресс-конференцию, при этом журналисты получали доступ только при условии подписания соглашения о конфиденциальности и не могли включить отзывы других учёных в свои статьи. Это вызвало резкую критику как со стороны учёных, так и со стороны журналистов, поскольку исключало возможность критических комментариев в журналистских публикациях, сообщавших об этом исследовании. Критиковались также и методы исследований. Специалисты отмечали, что крысы линии Спрег-Доули не подходят для подобных длительных исследований, поскольку даже в норме имеют почти 80-процентную заболеваемость раком. Серьёзные вопросы также вызвали методы статистической обработки результатов и отсутствие данных о количестве пищи, которой кормили крыс, и их темпов роста. Также специалистами было отмечено отсутствие зависимости доза-эффект и не определённые механизмы развития опухолей. Шесть французских национальных академий наук выпустили совместное заявление, критикующее исследование и журнал, опубликовавший его. Журнал «Food and Chemical Toxicology» опубликовал 17 писем от учёных, которые критиковали работу Сералини. Результатом критики стало то, что в ноябре 2013 года журнал отозвал публикацию статьи Сералини.
24 июня 2014 года статья переиздана без рецензирования в не входящем в крупнейшие наукометрические базы данных журнале Environmental Sciences Europe.
Композиционная эквивалентность
Для генетически модифицированных продуктов во многих странах действует принцип «композиционной эквивалентности» (en:substantial equivalence). Это означает что ГМ-культура считается не несущей больше рисков, чем обычная культура того же вида, если у них совпадает ряд параметров химического состава, особенно содержание питательных веществ. Некоторые ученые критикуют такой подход, так как взаимосвязь химического состава, биохимии и генетики до сих пор полностью не изучена, и есть вероятность существования неизвестных сейчас вредных веществ, содержание которых может измениться в результате генной модификации. Так, например, в статье, опубликованной в 2012, сравнивались свойства обычной (MG-BR46 Conquista) и созданной на её основе трансгенной (BRS Valiosa RR), устойчивой к глифосату сои. Показано, что и обычная и трансгенная соя при употреблении в пищу оказывают защитный эффект от повреждений ДНК у мышей, но у трансгенной сои этот эффект в среднем более чем в 2 раза ниже. Авторы исследования отметили, что их результаты коррелируют с более ранним сравнением свойств обычной и трансгенной сои (с такой же генной модификацией CP4 EPSPS). В указанном исследовании 2010 года наблюдался антимутагенный эффект диеты с 10 % и 20 % обычной сои, а также 10 % трансгенной. Диета с 20 % содержанием трансгенной сои такого эффекта не оказывала, а также статистически значимо снижала митотический индекс (что указывает на цитотоксическую активность). С другой стороны, в результате 15-дневного исследования не обнаружено гистологических изменений жизненно важных органов всех групп мышей. На основании полученных данных, авторы сделали вывод о необходимости дальнейшего исследования причин, ведущих к наблюдавшимся вредным или защитным действиям сои..
Горизонтальный перенос генов от продукта к потребителю
Опыты на мышах демонстрируют, что непереваренная ДНК пищи не способна проникать в кровь. Аналогичные исследования были проведены на цыплятах и телятах. Ни одного случая встраивания кусков инородной ДНК в геном потомства не наблюдалось.
Риск для окружающей среды
Одной из проблем, связанных с трансгенными растениями, является потенциальное влияние на ряд экосистем.
Миграция генов благодаря переопылению
Трансгены могут влиять на окружающую среду, если они попадут в дикие популяции и сохранятся там. Это относится и к конвенционной селекции. Необходимо учитывать следующие факторы риска:
- способны ли трансгенные растения расти за пределами посевной площади;
- может ли трансгенное растение передать свои гены местным диким видам и будет ли гибридное потомство плодовитым;
- дают ли трансгены своим носителям селективное преимущество перед дикими растениями.
Много одомашненных растений могут скрещиваться с дикими родственниками, когда они растут в непосредственной близости, и таким образом гены культивируемых растений могут быть переданы гибридам. Это касается как трансгенных растений, так и сортов конвенционной селекции, поскольку в любом случае речь идёт о генах, которые могут иметь негативные последствия для экосистемы после высвобождения в дикую природу. Это обычно не вызывает серьёзной обеспокоенности, невзирая на опасения по поводу «мутантов-супербурьянов», которые могли бы подавить местную дикую природу. Хотя гибриды между одомашненными и дикими растениями далеко не редкость, в большинстве случаев эти гибриды не являются плодовитыми благодаря полиплоидии и не сохраняются в окружающей среде на долгое время после того, как одомашненный сорт растений изымается из культивирования. Однако это не исключает возможность негативного влияния.
Пыльца одомашненных растений может распространяться на многие километры с ветром и оплодотворять другие растения. Это может усложнить оценку потенциального убытка от перекрёстного опыления, поскольку потенциальные гибриды расположены вдалеке от опытных полей. Для решения этой проблемы предлагаются системы, предназначенные для предотвращения передачи трансгенов, например, терминаторные технологии и методы генетической трансформации исключительно хлоропластов так, чтобы пыльца не была трансгенной. Что касается первого направления терминаторной технологии, то существуют предпосылки для несправедливого использования технологии, которая может способствовать большей зависимости фермеров от производителей. Генетическая трансформация хлоропластов не имеет таких особенностей, зато имеет технические ограничения, которые ещё необходимо преодолеть. На сегодняшний день ещё нет ни одного коммерческого сорта трансгенных растений со встроенной системой предотвращения переопыления.
Есть, по крайней мере, три возможных пути, которые могут привести к высвобождению трансгенов:
- гибридизации с нетрансгенными сельскохозяйственными культурами того же вида и сорта;
- гибридизация с дикими растениями одного и того же вида;
- гибридизация с дикими растениями близкородственных видов, как правило, одного и того же рода.
Однако нужно удовлетворить ряд условий, чтобы такие гибриды образовались:
- трансгенные растения должны культивироваться достаточно близко к диким видам, чтобы пыльца могла физически их достичь;
- дикие и трансгенные растения должны цвести одновременно;
- дикие и трансгенные растения должны быть генетически совместимыми.
Чтобы потомки сохранились, они должны быть жизнеспособными и плодотворными, а также содержать перенесённый ген.
Исследования показывают, что высвобождение трансгенных растений вероятнее всего может случиться путём гибридизации с дикими растениями родственных видов.
Известно, что некоторые сельскохозяйственные культуры способны скрещиваться с дикими предками. При этом, согласно базовым принципам популяционной генетики, распространение трансгенов в дикой популяции будет определяться скоростью притока генов в популяцию и селективным преимуществом, которое они дают. Выгодные гены будут быстро распространяться, нейтральные гены могут распространяться путём генетического дрейфа, невыгодные гены будут распространяться лишь в случае постоянного притока.
Экологическое влияние трансгенов не известно, но общепринято, что только гены, которые улучшают степень приспособления к абиотическим факторам, могут дать гибридным растениям достаточное преимущество, чтобы стать агрессивным бурьяном. Абиотические факторы, такие как климат, минеральные соли или температура, составляют неживую часть экосистемы. Гены, которые улучшают приспособление к биотическим факторам, могут нарушать (иногда очень чувствительный) баланс экосистемы. Так, например, дикие растения, которые получили ген стойкости к насекомым от трансгенного растения, могут стать более стойкими к одному из своих естественных вредителей. Это могло бы способствовать увеличению присутствия этого растения, а вместе с тем может уменьшиться количество животных, которые находятся выше вредителя, как источники еды в пищевой цепи. Тем не менее, точные последствия трансгенов с селективным преимуществом в естественной среде почти невозможно точно предугадать.
Миграция генов благодаря горизонтальному переносу генов
Отдельное замечание экологов вызывает использование гена из nptII кишечной палочки Escherichia coli, дающего стойкость к антибиотику канамицину, в качестве селективного маркера. Его содержит большинство коммерческих трансгенных растений. Считается, что этот ген может попасть с остатками ДНК растений в почву, а оттуда в геном грунтовых бактерий. В результате это приведёт к фиксации устойчивости к антибиотикам в бактериальной популяции и переносу её в болезнетворные бактерии.
ДНК трансгенных растений действительно некоторое время остаётся в грунте, хотя при этом и деградирует. Кроме того, бактерии способны «импортировать» в собственный геном чужеродные гены. Определена частота такого события в естественных условиях на бактерии Acinetobacter: перенос в геном бактерии кольцевой плазмиды 1,9 x 10−5, линеаризованной молекулы 2,0 x 10−8, перенос ДНК от трансгенных остатков — меньше предела чувствительности измерения 10−11.
Экспериментальные данные экологических исследований
По состоянию на 2007 год трансгенным хлопчатником в мире было засеяно 14 млн гектаров, из них 3,8 млн гектаров — в Китае. Хлопковая совка — один из самых серьёзных вредителей, личинка которого поражает не только хлопчатник, но и злаки, овощи и другие культурные растения. В Азии она за сезон даёт четыре поколения. Пшеница — основное растение-хозяин для первого поколения совки, а хлопчатник, соя, арахис и овощные культуры,— это хозяева для следующих трёх поколений. Главным агротехническим мероприятием борьбы с вредителем была интенсивная, 8-кратная за сезон, обработка полей инсектицидами. Такая методика борьбы привела, однако, к появлению стойкой к инсектицидам совки и, как результат,— вспышке количества вредителя в 1992 году. Это, соответственно, позднее привело к увеличению интенсивности обработки посевов инсектицидами.
В 1997 году на рынок был выпущен первый трансгенный хлопчатник, который содержит ген Bt-токсина. Его культивирование позволило добиться увеличения урожайности и снижение потребности в обработке полей инсектицидами — до двукратного применения за сезон. Результаты десятилетнего мониторинга экологической ситуации свидетельствуют, что с 1997 года плотность поражения личинкой совки снижалась и продолжает снижаться. Кроме того, популяция совки уменьшилась не только на трансгенном хлопчатнике, но и на других культурных растениях. Это объясняется тем, что хлопчатник, как растение-хозяин для второй сезонной волны размножения совки, существенно ослабляет эту вторую волну, что приводит к уменьшению численности особей третьей и четвёртой волны.
Одновременно с уменьшением популяции совки на хлопчатниковых полях несколько увеличилось количество другого вредителя — клопов из семейства Miridae. Этот факт объясняется снижением интенсивности применения инсектицидов, что создаёт более благоприятные условия для развития других вредителей.
Fusarium proliferatum — фитопатогенный грибок, который повреждает кукурузу и продуцирует цитотоксин фумонизин, нейро- и пневмотоксичный и канцерогенный для людей, а потому его содержание строго контролируется. Результаты экологического мониторинга конвенционных сортов и генно-модифицированной Bt-кукурузы продемонстрировали неожиданный эффект уменьшения поражение этим грибком генно-модифицированных сортов. Очевидно, грибок поражает преимущественно повреждённые насекомыми растения, а стойкие к насекомым трансгенные растения фузариозом не поражаются.

В 1999 году проведено первое экспериментальное исследование оценки риска влияния трансгенных растений на окружающую среду. Оценивали возможность и влияние токсичного загрязнения пыльцой Bt-кукурузы цветков ваточника сирийского Asclepias syriaca, пыльцой которого питается бабочка-монарх Danaus plexippus. Установлено, что в лабораторных условиях скармливания пыльцы Bt-кукурузы гусенице бабочки это приводит к замедлению её роста и повышенной смертности личинок. Более поздние исследования относительно оценки риска с учётом уровня экспозиции и загрязнения трансгенной пыльцой, использования пестицидов и других потенциальных токсичных веществ, показали, что влияние пыльцы Bt-кукурузы на популяцию бабочки монарха остаётся низким.
Аналогичное лабораторное исследование было проведено на личинках ручейника Hydropsyche borealis. Искусственное выкармливание личинок пыльцой Bt-кукурузы продемонстрировало увеличение смертности на 20 %. Те же авторы воспроизвели опыт в естественных условиях с целью проверки результатов, полученных в лабораторных условиях. Ручейники культивировались в контейнерах, установленных рядом с полями, засеянными Bt-кукурузой. В природных условиях влияния трансгенной пыльцы на жизнеспособность ручейников не наблюдалось.
Причиной массовой гибели медоносных пчел, которая достигла в США своего пика в 2007 году и которая получила название «коллапс пчелиных колоний», долгое время считалось выращивание Bt-культур. Позднее установлено, что причиной гибели пчел стала вирусная инфекция, а не ГМО.
Конфликты интересов и исследования безопасности
По данным исследования 2011 в случаях когда риски использования той или иной культуры исследовались либо за счёт производителя либо с участием ученых, аффилированных с производителем, результаты исследования оказывались неблагоприятными только в 2 % исследований, в случае отсутствия конфликта интересов результат был неблагоприятен в 23 % работ.
Регулирование допуска, торговли и маркировки ГМ-продуктов питания
Российское законодательство
До 2014 года в России ГМО можно было выращивать только на опытных участках, был разрешён ввоз некоторых сортов (не семян) кукурузы, картофеля, сои, риса и сахарной свёклы (всего 22 линии растений). С 1 июля 2014 года вступает в силу Постановление Правительства Российской Федерации от 23 сентября 2013 года № 839 «О государственной регистрации генно-инженерно-модифицированных организмов, предназначенных для выпуска в окружающую среду, а также продукции, полученной с применением таких организмов или содержащей такие организмы», которым разрешено сеять генно-модифицированные зерновые.
3 февраля 2015 года Правительство России предложило Госдуме законопроект, устанавливающий запрет на выращивание и разведение ГМО на территории РФ, за исключением их использования для проведения экспертиз и научно-исследовательских работ. В июле 2016 года Президентом РФ был подписан закон о запрете использования генно-модифицированных организмов кроме как в исследовательских целях. Одним из основных лоббистов закона стала ОАГБ (Общероссийская ассоциация генной безопасности) под руководством Е. А. Шаройкиной.
Украинское законодательство
На Украине допуск ГМ продуктов регулируют:
Закон «Про государственную систему биобезопасности при создании, проверке, транспортировании и использовании генетически модифицированных организмов».
Постановление от 18 февраля 2009 г. № 114 про «Порядок государственной регистрации генетически модифицированных организмов источников пищевых продуктов, а также пищевых продуктов, косметических и лекарственных средств, которые содержат такие организмы или полученные с их использованием».
Закон «О защите прав потребителей» (Статья 15. п 6) «Информация о продукции должна содержать: отметку о наличии или отсутствии в составе продуктов питания генетически модифицированных компонентов».
Таким образом, маркировке подлежат не только продукты, полученные из ГМО, а также пищевые добавки, полученные с помощью ГМО. Ни Европейское, ни законодательство Соединённых Штатов не предусматривает маркировку пищевых добавок, полученных с помощью генно-модифицированных микроорганизмов. Кроме того, Украина стала первым государством в мире, которое обязала производителей и импортёров пищевых продуктов указывать обозначение «без ГМО» в маркировке всех без исключения пищевых продуктов, даже тех, в которых ГМО не может быть даже теоретически.
3 октября 2012 года Кабинет Министров Украины одобрил законопроект, который разрешает не маркировать продукцию, не содержащую ГМО.
Законодательство США
Допуск генно-модифицированных продуктов регулируют три федеральных агентства Department of Agriculture' s Animal and Plant Health Inspection Service (APHIS), Environmental Protection Agency (EPA) и Food and Drug Administration (FDA).
Законы США
Министерство сельского хозяйства (APHIS)
7 CFR Part 340: Introduction of Organisms and Products Altered or Produced Through Genetic Engineering Which are Plant Pests or Which There is Reason to Believe are Plant Pests (Внедрение организмов и продуктов, которые изменены или выработаны с помощью генной инженерии и является вредителями растений или, тех о которых существуют основания считать, что они являются вредителями растений).
Министерство охраны окружающей среды (EPA)
40 CFR Parts 152 and 174: Pesticide Registration and Classification Procedures (Регистрация пестицидов и их классификация).
40 CFR Part 172: Experimental Use Permits (Разрешение для экспериментального использования).
40 CFR Part 725: Reporting Requirements and Review Processes for Microorganisms (Требования к отчётности и процессы осмотра для микроорганизмов).
Управление по санитарному контролю за качеством пищевых продуктов и медикаментов (FDA)
Statement of Policy: Foods Derived From New Plant Varieties (Продукты, полученные из новых видов растений).
Дополнение: Consultation Procedures under FDA’s 1992 Statement of Policy.
Реестр генно-модифицированных растений, допущенных к культивированию и продаже в мире, а также тех, которые ожидают допуск к коммерциализации, можно найти на сайте Biotechnology industry organizations. Перечень касается продуктов, изготовленных такими фирмами: BASF Plant Science, Bayer CropScience LP, Dow AgroSciences LLC, Monsanto Company, Pioneer, Dupont Company и Syngenta Seeds Inc.
В апреле 2016 года в продажу поступили шампиньоны, не темнеющие на воздухе, изменённые с помощью метода CRISPR. Эти грибы были признаны не подлежащими регулированию и были допущены на рынок без проверок.
Европейское законодательство
В Европейском Союзе допуск ГМО регулируется двумя законодательными актами:
- Directive on the Deliberate Release into the Environment of Genetically Modified Organisms (2001/18). Данный закон регулирует правила коммерческого допуска ГМ-растений (способных к размножению), и выпуск таких растений в окружающую среду.
- Regulation on Genetically Modified Food and Feed (1829/2003). Этот закон регулирует допуск на рынок еды и кормов, которые изготовлены или содержат ГМ-растения.
Кроме этих двух законов, существует целый ряд уточняющих нормативных актов. Полный перечень трансгенных растений, которые допущены к коммерциализации в Европе, можно найти на сайте GMO compass.
Другие мировые регулирующие акты
Продовольственная и сельскохозяйственная организация ООН вместе с Всемирной организацией охраны здоровья разработали приложение к Кодекс Алиментариус — «Foods derived from modern biotechnology», регулирующий правила безопасности относительно генно-модифицированных продуктов.
Проблемы согласования законодательств
Законы, которые регулируют допуск ГМ-продуктов на рынок, сходны, но в их реализации есть расхождения. США декларирует политику свободной торговли, а Европа допускает свободную торговлю с определёнными ограничениями, что базируется на принципе осторожности. В 2003 году США, Канада и Аргентина подали жалобу в Всемирную торговую организацию относительно ограничений со стороны Европы. В 2005 году ВТО удовлетворила большинство пунктов жалобы.
Также наблюдается асинхронный допуск ГМ-продуктов в разных странах, что вызывает искусственную замену торговых приоритетов[прояснить]. Например, согласно с Европейским законодательством, продукты скрещивания допущенного ранее и коммерциализованного генно-модифицированного сорта с конвенционными сортами, считаются новым ГМ-продуктом и подлежат новой процедуре допуска. В США такие продукты отдельного разрешения не требуют.
Подавляющее количество допусков ГМ в Европе касается разрешений на импорт сырья, а не культивирование. Европа импортирует трансгенное сырьё, содержание которого в готовом продукте не должно превышать 0,9 %. В результате асинхронных допусков ожидается или перестройка торговых рынков, или Европа откажется от принципа нулевой толерантности.
См. также
Литература
- Панчин А. Ю. Сумма биотехнологии. Руководство по борьбе с мифами о генетической модификации растений, животных и людей. — М.:АСТ. — 2015. — 432 с. ISBN 978-5-17-093602-1
Ссылки
| В библиографических каталогах |
|---|

