
Болезнь Паркинсона
| Болезнь Паркинсона | |
|---|---|
 Пациент с болезнью Паркинсона. Рисунок из руководства 1886 года Уильяма Говерса | |
| МКБ-11 | 8A00.0 |
| МКБ-10 | G20 |
| МКБ-10-КМ | G20 и F02.3 |
| МКБ-9 | 332 |
| МКБ-9-КМ | 332.0 и 332 |
| OMIM | 168600 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine | neuro/304 |
| MeSH | D010300 |
Боле́знь Паркинсо́на (синонимы: идиопатический синдром паркинсонизма, дрожательный паралич) — медленно прогрессирующее хроническое нейродегенеративное неврологическое заболевание, характерное для лиц старшей возрастной группы. Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведёт к тормозному влиянию базальных ганглиев на кору головного мозга. Ведущими (основными, или кардинальными) симптомами являются:
- мышечная ригидность;
- гипокинезия;
- тремор;
- постуральная неустойчивость.
Современная медицина пока не может излечить это заболевание, однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных и замедлить прогрессирование болезни.
Термин «паркинсонизм» является общим понятием для ряда заболеваний и состояний с вышеназванными ведущими симптомами. Однако наиболее значимой из форм паркинсонизма является болезнь Паркинсона — идиопатическое заболевание (что означает болезнь самостоятельную, не вызванную генетическими нарушениями или другими заболеваниями).
Своим названием болезнь Паркинсона обязана французскому неврологу Жану Шарко. Он предложил назвать её в честь британского врача и автора «Эссе о дрожательном параличе» Джеймса Паркинсона, чей труд не был должным образом оценён при жизни.
Содержание
- 1 История изучения
- 2 Эпидемиология
- 3 Этиология
- 4 Патогенез
- 5 Симптоматика
- 6 Диагностика и дифференциальный диагноз. Другие виды паркинсонизма
- 7 Стадии паркинсонизма по Хён и Яру (Hoehn, Yahr, 1967)
- 8 Лечение
- 9 Исследования на животных
- 10 Клинические испытания
- 11 Прогноз
- 12 Известные люди, ставшие жертвами болезни Паркинсона
- 13 См. также
- 14 Примечания
- 15 Литература
- 16 Ссылки
История изучения

Проявления болезни Паркинсона были описаны за несколько тысячелетий до опубликования в 1817 году Джеймсом Паркинсоном «Эссе о дрожательном параличе» (англ. An Essay on the Shaking Palsy).
В египетском папирусе XII столетия до н. э. у одного из фараонов отмечены характерные для заболевания симптомы. В Библии описаны люди с тремором. В текстах Аюрведы заболевание, проявляющееся тремором, ограничением движений, слюнотечением и другими характерными симптомами, рекомендовано лечить некоторыми видами бобовых. Знаменитый древнеримский врач Гален, по всей видимости, ещё во II столетии н. э. описал болезнь Паркинсона, указав на её симптомы — тремор покоя (дрожь покоящихся частей тела), постуральную неустойчивость и мышечную ригидность.
После Галена симптомы паркинсонизма вновь были описаны лишь в XVII столетии. Голландский врач и анатом Франциск Сильвий отметил отличие тремора покоя от других видов дрожания, немец Иероним Гобий выделил симптомы характерной для паркинсонизма походки. Знаменитый шотландский хирург Джон Хантер дал подробное описание больного паркинсонизмом.
В 1817 году английский врач Джеймс Паркинсон опубликовал «Эссе о дрожательном параличе». В нём он описал шестерых больных людей, подробно остановившись на таких характерных симптомах заболевания, как тремор покоя, патологическая походка и постуральная неустойчивость, мышечная ригидность и другие. Также он оценил их динамику при прогрессировании заболевания. Работа оставалась незамеченной в течение 40 лет после опубликования. Классические исследования неврологов У. Говерса, С. Вильсона, В. Эрба и Ж. Шарко в 1868—1881 годах позволили выделить болезнь Паркинсона как самостоятельное заболевание. По предложению знаменитого французского невролога Шарко заболевание получило имя британского врача Паркинсона, чей труд не был должным образом оценён при жизни.
После определения болезни Паркинсона как самостоятельного заболевания возник вопрос о том, поражение каких структур приводит к его симптомам. Французский невролог Эдуард Бриссо в конце XIX столетия предположил, что за развитие заболевания ответственны субталамическое ядро и ножки мозга (отдел среднего мозга). В 1912 году Фредерик Леви обнаружил специфические клеточные включения в клетках ствола мозга, характерные для болезни Паркинсона, впоследствии названные тельцами Леви. В 1919 году русский невролог К. Н. Третьяков определил, что основные патологические изменения при заболевании возникают в чёрной субстанции. Предположения К. Н. Третьякова не признавались медицинским сообществом до их подтверждения немецким патологоанатомом Рольфом Хасслером в 1948 году.
Биохимические изменения, которые лежат в основе заболевания, стали изучать в 1950-х годах. За исследования нейротрансмиттера дофамина, играющего важную роль в развитии заболевания, шведский фармаколог Арвид Карлссон получил Нобелевскую премию по физиологии и медицине в 2000 году. Состав телец Леви был расшифрован в 1997 году.
Вместе с исследованиями природы заболевания развивались методы его лечения. Неврологи конца XIX — начала XX столетий отмечали положительный эффект алкалоидов группы атропина белладонны. В 1939 году была предпринята попытка хирургического лечения — деструкция базальных ганглиев. Эти методики были усовершенствованы за последующие 20 лет. До внедрения в клиническую практику леводопы антихолинергические препараты и хирургическое разрушение базальных ядер оставались основными методами лечения болезни Паркинсона. В конце 1980-х годов стимуляция глубинных структур мозга электрическими импульсами была признана возможным методом лечения заболевания.
Эпидемиология
Болезнь Паркинсона составляет 70—80 % случаев синдрома паркинсонизма. Она является наиболее частым нейродегенеративным заболеванием после болезни Альцгеймера. Заболевание встречается повсеместно. Его частота колеблется от 60 до 140 человек на 100 тысяч населения, число больных значительно увеличивается среди представителей старшей возрастной группы. Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %, а старше 85 лет — от 2,6 % до 4 %. Чаще всего первые симптомы заболевания появляются в 55—60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 лет (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания).
Мужчины болеют несколько чаще, чем женщины. Существенных расовых различий в структуре заболеваемости не выявлено.
Этиология
Этиология болезни Паркинсона на вторую половину 2011 года окончательно не выяснена. Этиологическими факторами риска считаются старение, генетическая предрасположенность, воздействие факторов окружающей среды. Патоморфологически нормальное старение сопровождается уменьшением числа нейронов чёрной субстанции и наличием в них телец Леви. Старению также сопутствуют нейрохимические изменения в стриатуме — снижение содержания дофамина и фермента тирозингидроксилазы, а также уменьшение числа дофаминовых рецепторов. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении.
Около 15 % людей с болезнью Паркинсона имеют семейный анамнез данного заболевания. Однако гены, ответственные за развитие болезни Паркинсона, не идентифицированы.
Причинами паркинсоноподобных проявлений также могут быть воздействие факторов окружающей среды (пестициды, гербициды, соли тяжёлых металлов), хроническая цереброваскулярная недостаточность или употребление лекарств, вызывающих экстрапирамидные побочные эффекты.
Экологические факторы
Установлено, что после инъекции вещества 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) развивается паркинсонизм. МФТП проникает через ГЭБ и под действием МАО-B окисляется до 1-метил-4-фенилпиридина (МФП+). МФП+ проникает в митохондрии и ингибирует комплекс I дыхательной цепи. Сходство химического строения МФТП и некоторых пестицидов (например, ротенон, паракват) и гербицидов (например, Агент Оранж) позволило предположить, что МФТП-подобные токсины окружающей среды способствуют развитию болезни Паркинсона. К факторам риска относят также проживание в сельской местности и близость промышленных предприятий и карьеров.
Риск развития болезни Паркинсона у курильщиков в 3 раза ниже, чем у некурильщиков. Предполагают, что это связано с дофамин-стимулирующим эффектом никотина. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО. От развития болезни Паркинсона защищает также употребление кофеина.
Окислительная гипотеза
Окислительная гипотеза предполагает, что свободные радикалы, образующиеся при окислительном метаболизме дофамина, играют важную роль в развитии и прогрессировании болезни Паркинсона. Содержание веществ, которые могут служить донором электронов, в чёрном веществе увеличивается, что способствует образованию свободных радикалов. Кроме того, при окислении дофамина под действием МАО образуется пероксид водорода. Если пероксид водорода не связывается с глутатионом, то происходит накопление весьма реактивных гидроксильных радикалов, которые вступают в реакцию с липидами клеточных мембран, вызывая перекисное окисление липидов и гибель клеток.
Патогенез
Патологическая анатомия


При болезни Паркинсона поражаются структуры экстрапирамидной системы — базальные ядра и чёрное вещество, голубое пятно и другие. Наиболее выраженные изменения отмечают в передних отделах чёрной субстанции. Характерные для болезни Паркинсона симптомы возникают при гибели 60—80 % нейронов этого анатомического образования.
Макроскопические изменения характеризуются депигментацией содержащих меланин областей чёрного вещества и голубого пятна. При микроскопическом исследовании поражённых областей выявляют уменьшение числа нервных клеток. В них определяется наличие телец Леви. Также происходит гибель астроцитов (разновидности глиальных клеток) и активация микроглии. Тельца Леви образуются вследствие скопления в цитоплазме белка α-синуклеина. Наличие телец Леви — один из признаков болезни Паркинсона.
Тельца Леви обнаруживают также и при других нейродегенеративных заболеваниях. В связи с этим они не считаются специфическим маркером болезни Паркинсона. Кроме того, при данном заболевании в чёрной субстанции и голубом пятне обнаружены «бледные тельца» — внутриклеточные гранулярные включения, которые замещают распадающийся меланин.
Согласно предложенной Брааком и соавторами классификации, в асимптоматической стадии болезни Паркинсона тельца Леви появляются в нервных клетках обонятельной луковицы, продолговатого мозга и варолиевого моста. С прогрессированием заболевания наличие данных патологических телец отмечается в нейронах чёрной субстанции, среднего мозга, базальных ганглиев и на конечных этапах в клетках коры головного мозга.
Патологическая физиология
Тесная взаимосвязь между составляющими экстрапирамидной системы — паллидумом и стриатумом — обеспечивается многочисленными пучками нервных волокон. Благодаря связям между таламусом и стриопаллидарной системой образуются рефлекторные дуги, обеспечивающие выполнение многочисленных стереотипных и автоматизированных движений (например, ходьба, бег, плаванье, езда на велосипеде и др.). Тесная связь стриопаллидарной системы с ядрами гипоталамуса определяет её роль в механизмах эмоциональных реакций.
В норме экстрапирамидная система посылает импульсы к периферическим двигательным нейронам. Эти сигналы играют важную роль в обеспечении миостатики путём готовности мышц к произвольным движениям. От деятельности данного отдела центральной нервной системы зависит способность человека принимать оптимальную для намеченного действия позу, достигается необходимое соотношение тонуса мышц-агонистов и мышц-антагонистов, а также плавность и соразмерность произвольных движений во времени и пространстве.
Характер клинических проявлений болезни зависит от того, какая часть стриопаллидарной системы поражена — стриатум или паллидум. Если чрезмерно тормозящее влияние стриатума, возникает гипокинезия — бедность движений, амимия. Гипофункция стриатума приводит к возникновению избыточных непроизвольных движений — гиперкинезов. Паллидум оказывает тормозящее воздействие на структуры стриатума. Для болезни Паркинсона характерно снижение тормозящего влияния паллидума на стриатум. Повреждение паллидума приводит к «торможению торможения» периферических двигательных нейронов.
Открытие роли нейромедиаторов позволило объяснить функции экстрапирамидной системы, а также причины возникновения клинических проявлений болезни Паркинсона и паркинсонизма. В мозге существует несколько дофаминергических систем. Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции).
Основу всех форм паркинсонизма составляет резкое уменьшение количества дофамина в чёрной субстанции и полосатом теле и соответственно нарушение функционирования дофаминергических проводящих путей головного мозга.
Симптоматика
Для болезни Паркинсона характерны 4 двигательных нарушения: тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость, — а также вегетативные и психические расстройства.
Тремор (дрожание) — наиболее очевидный и легко выявляемый симптом. Для паркинсонизма характерен тремор, возникающий в покое, хотя редко возможны и другие типы (постуральный, интенционный). Его частота 4—6 Гц (движений в секунду). Он обычно начинается в дистальном отделе одной руки, при прогрессировании заболевания распространяясь на противоположную руку и на ноги. Разнонаправленные движения большого и других пальцев внешне напоминают счёт монет или скатывание пилюль (схожесть с ручной техникой создания пилюль в фармацевтике). Иногда также отмечается дрожание головы по типу «да-да» или «нет-нет», дрожание век, языка, нижней челюсти. В редких случаях оно охватывает всё тело. Тремор усиливается при волнении и стихает во время сна и произвольных движений. В отличие от мозжечкового тремора, который появляется при движении и отсутствует в покое, при болезни Паркинсона типично его наличие в покое и уменьшение или исчезновение при движениях.
Гипокинезия — снижение спонтанной двигательной активности. Больной может застывать, часами сохраняя неподвижность. Характерна общая скованность. Активные движения возникают после некоторого промедления, темп их замедлен — брадикинезия. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу — кукольная походка. Лицо маскообразное (амимия), взгляд застывший, мигания редкие. Улыбка, гримаса плача возникают с запозданием и так же медленно исчезают.
Речь лишена выразительности, монотонна и имеет тенденцию к затуханию. В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким — микрография.
Одним из проявлений олигокинезии (уменьшение количества движений) является отсутствие физиологических синкинезий (содружественных движений). При ходьбе руки не совершают обычных размашистых движений, они остаются прижатыми к туловищу (ахейрокинез). При взгляде вверх не отмечается наморщивания лба. Сжатие пальцев в кулак не сопровождается разгибанием кисти. Больной не может выполнять несколько целенаправленных движений одновременно. Все действия напоминают автоматические.
Мышечная ригидность — равномерное повышение тонуса мышц по пластическому типу. Конечности при их сгибании и разгибании застывают в приданном им положении. Такая форма повышения мышечного тонуса называется «пластической восковой гибкостью». Преобладание ригидности в определённых группах мышц приводит к формированию характерной позы просителя (также называют «поза манекена»): больной сутулится, голова наклонена вперёд, полусогнутые в локтевых суставах руки прижаты к телу, ноги также слегка согнуты в тазобедренных и коленных суставах. При пассивном сгибании-разгибании предплечья, головы, круговых движениях в лучезапястном суставе можно ощутить своеобразную прерывистость, ступенчатость напряжения мышц — «симптом зубчатого колеса».
Изменения мышечного тонуса ведут к нарушению тенденции конечности к возвращению в исходную позицию после совершённого движения. Например, после резкого пассивного тыльного сгибания стопы она некоторое время сохраняет приданную ей позицию — феномен Вестфаля.
Постуральная неустойчивость развивается на поздних стадиях заболевания. У больного отмечаются затрудения преодоления как инерции покоя, так и инерции движения. Больному сложно начать движение, а начав его, трудно остановиться. Возникают явления пропульсии (лат. propulsio — проталкивание вперёд), латеропульсии и ретропульсии. Они выражаются в том, что, начав движение вперёд, в сторону или назад, туловище обычно как бы опережает ноги, в результате чего нарушается положение центра тяжести. Человек теряет устойчивость и падает. Иногда у больных определяют «парадоксальные кинезии», когда вследствие эмоциональных переживаний, после сна либо вследствие других факторов человек начинает свободно передвигаться, пропадают характерные для заболевания симптомы. Через несколько часов симптоматика возвращается.
Вегетативные и психические расстройства. Кроме нарушений двигательной сферы, при болезни Паркинсона отмечаются вегетативные расстройства, а также нарушения обмена веществ. Следствием может быть либо истощение (кахексия), либо ожирение. Секреторные расстройства проявляются сальностью кожных покровов, особенно лица, повышенным слюноотделением, избыточной потливостью.
Психические расстройства при болезни Паркинсона могут быть обусловлены как самим заболеванием, так и антипаркинсоническими препаратами. Начальные признаки психоза (страх, растерянность, бессонница, галлюцинаторно-параноидное состояние с нарушением ориентировки) отмечают у 20 % амбулаторных и двух третей больных с тяжёлой формой паркинсонизма. Слабоумие выражено слабее, чем при сенильной деменции. У 47 % наблюдают депрессии, у 40 % — расстройства сна и патологическую утомляемость. Больные безынициативны, вялы, а также назойливы, склонны к повторению одних и тех же вопросов.
Различают несколько клинических форм заболевания — ригидно-брадикинетическую, дрожательно-ригидную и дрожательную:
- Ригидно-брадикинетическая форма характеризуется повышением тонуса мышц по пластическому типу, прогрессирующим замедлением активных движений вплоть до обездвиженности. Появляются мышечные контрактуры. Характерна «поза манекена» («поза просителя»).
- Дрожательно-ригидная форма характеризуется тремором конечностей, преимущественно их дистальных отделов, к которому присоединяется скованность произвольных движений.
- Для дрожательной формы характерно наличие постоянного или почти постоянного средне- и крупноамплитудного тремора конечностей, языка, головы, нижней челюсти. Тонус мышц нормальный или несколько повышен. Темп произвольных движений сохранён.
Диагностика и дифференциальный диагноз. Другие виды паркинсонизма
Диагностика болезни Паркинсона в большинстве случаев не вызывает затруднений — достаточно наличия у пациента гипокинезии и одного из симптомов: тремора покоя, ригидности, постуральных нарушений в сочетании с положительным эффектом от приёма леводопы. На начальных этапах заболевания, когда проявления заболевания не выражены либо выражены слабо, правильной диагностике может способствовать выявление постуральных рефлексов (рефлексов положения). К ним относится описанный выше феномен Вестфаля, а также феномен Фуа—Тевенара (либо феномен голени). Данные рефлексы возникают вследствие повышения пластического тонуса мышц. Феномен голени проявляется тем, что максимально согнутая в коленном суставе нога больного, который лежит на животе, опускается медленно и обычно разгибается не полностью.
Дифференциальный диагноз болезни Паркинсона с другими патологиями проходит в два этапа. Следует исключить состояния и процессы, при которых имеются схожие с паркинсонизмом симптомы. При наличии у больного паркинсонизма необходимо учитывать, что данный синдром характерен для ряда заболеваний.
Патогномоничные для паркинсонизма симптомы наблюдаются при следующих расстройствах:
- психомоторная заторможенность — депрессия, кататонический ступор, истерия, гиперсомния
- мышечный гипертонус — нейромиотония, синдром «ригидного человека»
- апраксия ходьбы — нормотензивная гидроцефалия, опухоли мозга и др.
- тремор — поражение мозжечка
Паркинсонизм также может быть вызван целым рядом заболеваний. В большинстве случаев (~80 %) он вызван поражением нигростриарной системы вследствие болезни Паркинсона. При поражениях соответствующих отделов центральной нервной системы другой этиологии будут возникать токсический, лекарственный, постэнцефалитический, сосудистый, посттравматический и другие паркинсонизмы.
При многих заболеваниях развивается синдром паркинсонизма в сочетании с симптомами поражения других отделов центральной нервной системы. Для обозначения данной группы заболеваний используют термин «паркинсон-плюс».
В 2022 году исследователи из Университета Кобе и Университета Хиросимы нашли новый биомаркер, позволяющий с помощью теста выявлять болезнь Паркинсона на ранних стадиях с точностью до 85-88%.
| Тип | Форма | Частота, % |
|---|---|---|
| Первичный (идиопатический) паркинсонизм | Болезнь Паркинсона | 80,2 |
| Ювенильный паркинсонизм | * | |
| Вторичный паркинсонизм | Постэнцефалитический | 0,5 |
| Лекарственный | 3,9 | |
| Сосудистый | 2,1 | |
| Токсический | * | |
| Травматический | * | |
| Паркинсонизм, связанный с тиреоидными нарушениями, гипотиреоидизмом, гепатоцеребральной дегенерацией, опухолью мозга, гидроцефалией, сирингомезенцефалией | * | |
| Паркинсонический синдром при мультисистемной дегенерации — «паркинсонизм-плюс» |
Прогрессирующий супрануклеарный паралич (синдром Стила—Ричардсона) | 7,4 |
| Синдром Шая—Драйжера | 1,7 | |
| Стриато-нигральная дегенерация | 0,4 | |
| Комплекс паркинсонизм—деменция—боковой амиотрофический склероз | 0,2 | |
| Кортико-базальная дегенерация | 0,5 | |
| Болезнь диффузных телец Леви | 1,2 | |
| Болезнь Галлервордена—Шпатца | 0,3 | |
| Оливо-понто-церебральная дегенерация | * |
* Формы паркинсонизма, частота встречаемости которых не указана, диагностируют редко, и в сумме они составляют 2,2 %.
В соответствии с последними соглашениями Европейской ассоциации болезни Паркинсона синдром паркинсонизма подразделяется на четыре группы:
- идиопатический паркинсонизм
- генетические формы паркинсонизма, семейный синдром паркинсонизма — наследственная форма, обозначается локализацией гена (например, PARK1)
- паркинсонизм в рамках других нейродегенеративных заболеваний (атипичные формы паркинсонизма, иногда называемые благодаря дополнительным симптомам «синдром паркинсонизм плюс»)
- симптоматические синдромы Паркинсона — например, как следствие некоторых медикаментов, амфетаминов, травм, опухолей, действия токсических веществ, эндокринно-метаболических нарушений, воспалительно-инфекционных заболеваний
Идиопатический и атипичный паркинсонизм могут в качестве проявлений нейродегенеративных заболеваний классифицироваться как синуклеинопатии (идиопатический паркинсонизм, мультисистемная атрофия, деменция с тельцами леви) или таупатии (прогрессирующий супрануклеарный парез взора, кортико-базальная деменция).
В 1992 году британский врач Хьюз предложил критерии диагностики болезни Паркинсона, позволяющие установить диагноз с точностью до 93 % (согласно данным аутопсий):
- Наличие гипокинезии и как минимум одного из следующих симптомов: ригидность, тремор покоя 4—6 Гц, постуральные нарушения.
- Асимметричный дебют заболевания (стадия гемипаркинсонизма).
- Прогрессирующее течение.
- Отсутствие в анамнезе возможных этиологических факторов вторичного паркинсонизма (приём нейролептиков, достоверно перенесённый энцефалит, острые нарушения мозгового кровообращения, повторные или тяжёлые черепно-мозговые травмы).
- Отсутствие следующих симптомов:
- a) на всех стадиях заболевания
- отчётливой мозжечковой и/или пирамидной симптоматики
- надъядерного паралича взора
- окулогирных кризов
- b) на ранних стадиях заболевания
- грубых постуральных расстройств
- грубой прогрессирующей вегетативной недостаточности
- грубой деменции
Эти критерии должны соблюдаться лишь при отборе больных для научных исследований. Для предварительного диагноза достаточно выполнение лишь первых двух пунктов.
Стадии паркинсонизма по Хён и Яру (Hoehn, Yahr, 1967)
Наиболее часто применяемой в медицине является классификация стадий паркинсонизма по Хён и Яру. Впервые она была опубликована в 1967 году в журнале Neurology Маргарет Хён (англ. Hoehn) и Мелвином Яром (англ. Yahr). Изначально она описывала 5 стадий прогрессирования болезни Паркинсона (1 — 5). Впоследствии шкалу модифицировали, дополнив её стадиями 0, 1,5 и 2,5.
- Стадия 0 — нет признаков заболевания.
-
Стадия 1 — симптомы проявляются на одной из конечностей.
- Стадия 1,5 — симптоматика проявляется на одной из конечностей и туловище.
-
Стадия 2 — двусторонние проявления без постуральной неустойчивости.
- Стадия 2,5 — двусторонние проявления с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком.
- Стадия 3 — двусторонние проявления. Постуральная неустойчивость. Больной способен к самообслуживанию.
- Стадия 4 — обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки.
- Стадия 5 — больной прикован к креслу или кровати. Тяжёлая инвалидизация.
Лечение

Консервативное лечение
В настоящее время болезнь Паркинсона является неизлечимой, все существующие методы лечения направлены на облегчение её симптомов (симптоматическое лечение). Основные препараты, устраняющие двигательные нарушения: леводопа (чаще в комбинации с периферическими ингибиторами ДОФА-декарбоксилазы или реже с ингибиторами КОМТ), агонисты дофаминовых рецепторов и ингибиторы МАО-Б.
Дофаминергические препараты
Диоксифенилаланин (сокращённо допа, или дофа) — биогенное вещество, которое образуется в организме из тирозина и является предшественником дофамина, в свою очередь являющегося предшественником норадреналина. В связи с тем, что при болезни Паркинсона содержание дофамина в головном мозге значительно снижено, для лечения заболевания целесообразно применение веществ, повышающих его содержание в ЦНС. Сам дофамин не может быть использован для этой цели, так как он плохо проникает через гемато-энцефалический барьер.
Леводопа

В качестве лекарственного препарата широко применяют синтетический левовращающий изомер диоксифенилаланина (сокращённо L-дофа), который значительно активнее правовращающего. Леводопа хорошо всасывается при приёме внутрь. Бо́льшая часть препарата попадает в печень и превращается в дофамин, который не проникает через гемато-энцефалический барьер. Для уменьшения декарбоксилирования препарат рекомендуют применять с ингибиторами дофа-декарбоксилазы (бенсеразидом, карбидопой).
Препарат эффективен при болезни Паркинсона и паркинсонизме. Он уменьшает гипокинезию и ригидность. При треморе, дисфагии и слюнотечении лечебный эффект достигается у 50—60 %.
Препарат можно назначать с центральными холиноблокаторами и не следует применять с необратимыми ингибиторами моноаминоксидазы (МАО).
При применении возможны побочные эффекты: диспепсические явления (тошнота, рвота, потеря аппетита), гипотензия, аритмии, гиперкинезы и др.
У пациентов младше 60—70 лет назначение леводопы из-за развития побочных явлений и снижения эффективности при длительной терапии стараются отложить и применяют другие лекарственные средства. Лечение пациентов старше 70 лет даже в начальных стадиях рекомендуют начинать с леводопы, что объясняют меньшей эффективностью препаратов других групп и более частыми соматическими и психическими побочными эффектами в этом возрасте.
Агонисты дофамина
В качестве основного лечения также используются агонисты дофаминовых рецепторов (бромокриптин, перголид, прамипексол, ропинирол, каберголин, апоморфин, лизурид). Препараты данной группы являются специфическими центральными агонистами дофаминовых рецепторов. Имитируя действие дофамина, они вызывают те же фармакологические эффекты, что и леводопа.
По сравнению с леводопой они реже вызывают дискинезии и другие двигательные расстройства, но чаще оказывают иные побочные эффекты: отёки, сонливость, запоры, головокружение, галлюцинации, тошноту.
Ингибиторы МАО типа Б и катехол-О-метилтрансферазы
Данная группа препаратов избирательно подавляет активность ферментов, которые расщепляют дофамин: моноаминоксидаза (МАО типа Б) и катехол-О-метилтрансфераза (КОМТ). ингибиторы МАО-Б (например, селегилин, разагилин] и ингибиторы КОМТ (например, энтакапон и толкапон) замедляют неуклонное прогрессирование болезни Паркинсона. Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая и даже снижая её суммарную дозу.
Ингибиторы обратного нейронального захвата дофамина

Непрямые дофаминомиметики (амантадин) повышают чувствительность рецепторов к соответствующему медиатору. Данные препараты усиливают выделение дофамина из пресинаптических окончаний и тормозят его обратный нейрональный захват. Лекарственные средства данной группы вызывают те же фармакологические эффекты, что и леводопа, то есть они преимущественно подавляют гипокинезию и мышечную ригидность, значительно меньше влияя на тремор.
Центральные холиноблокаторы
Для лечения паркинсонизма применяют антихолинергические средства. Знаменитый французский врач Жан Шарко ещё в 1874 году использовал белладонну для уменьшения наблюдаемой при заболевании усиленной саливации. Им также было отмечено уменьшение тремора при её приёме. В дальнейшем для лечения стали использовать не только препараты белладонны, но и другие холиноблокаторы — атропин и скополамин. После появления синтетических холинолинолитиков стали применяться тригексифенидил (циклодол), трипериден, бипериден, тропацин, этпенал, дидепил и динезин.
Применение холиноблокаторов патогенетически обосновано. Поражения чёрной субстанции и других нервных образований приводит к существенным сдвигам в холин- и дофаминергических процессах, а именно повышению холинергической активности и снижению дофаминергической. Таким образом, центральные холиноблокаторы «выравнивают» нейромедиаторные взаимодействия.
Применяемые ранее препараты белладонны действуют преимущественно на периферические ацетилхолиновые рецепторы и меньше — на холинорецепторы мозга. В связи с этим терапевтическое действие данных препаратов относительно невелико. Вместе с этим они вызывают ряд побочных явлений: сухость во рту, нарушение аккомодации, задержку мочи, общую слабость, головокружение и др.
Современные синтетические противопаркинсонические центральные холиноблокаторы характеризуются более избирательным действием. Они широко применяются при лечении экстрапирамидных заболеваний, а также неврологических осложнений, вызываемых нейролептиками.
Отличительным свойством центральных холиноблокаторов является то, что они в большей степени воздействуют на тремор; в меньшей мере влияют на ригидность и брадикинезию. В связи с периферическим действием уменьшается слюнотечение, в меньшей степени потоотделение и сальность кожи.
Хирургическое лечение
Хирургические методы лечения можно разделить на два типа: деструктивные операции и стимуляцию глубинных мозговых структур.
Деструктивные операции
К деструктивным операциям, применяемым при болезни Паркинсона, относятся таламо- и паллидотомия.
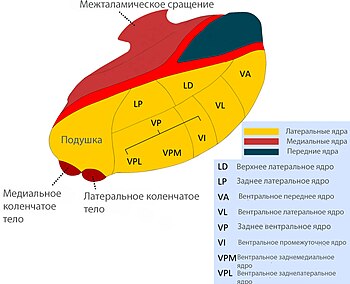
Таламотомия показана лишь в тех случаях, когда основным симптомом заболевания является тремор. Для получения положительного результата от операции больные должны соответствовать нескольким критериям: болезнь Паркинсона проявляется односторонним тремором, консервативное лечение неэффективно. Показано, что разрушение вентрального промежуточного ядра таламуса (лат. nucleus ventralis intramedius) приводит к снижению тремора у больных паркинсонизмом. Согласно литературным данным, эффективность операции по устранению тремора при болезни Паркинсона достигает 96 %. При этом те же авторы отмечают высокий риск осложнений (13 % стойких и 56 % преходящих). К осложнениям, возникающим после таламотомии, относят дизартрию, абулию, дисфазию, диспраксию.
Паллидотомия может быть показана больным с преобладанием двигательных расстройств, для которых консервативное лечение неэффективно. Процедура заключается во введении иглы в бледный шар (лат. globus pallidus) с последующим его частичным разрушением.
Паллидотомия является относительно безопасной процедурой. При анализе 85 статей, посвящённых паллидотомии, и соответственно результатов лечения 1510 больных выделены такие осложнения данной операции:
| Осложнение | К-во больных | Уровень (%) |
|---|---|---|
| Внутричерепное кровоизлияние | 26 | 1,7 % |
| Постоперационный психоз | 8 | 0,5 % |
| Гиперсаливация | 9 | 0,6 % |
| Судорожные приступы | 8 | 0,5 % |
| Нарушение фонации | 20 | 1,3 % |
| Нарушение полей зрения | 30 | 2,0 % |
| Депрессия | 13 | 0,9 % |
| Нарушение функции лицевого нерва | 56 | 3,7 % |
| Дизартрия | 18 | 1,2 % |
| Нарушение памяти | 19 | 1,3 % |
| Слабость в одной из конечностей | 24 | 1,6 % |
| Другие осложнения | 30 | 2,0 % |
Эффективность паллидотомии при болезни Паркинсона достаточно высока. Гипокинезия в противоположных стороне операции конечностях снижается в 82 % случаев.
С развитием радиохирургии появилась новая возможность производить разрушение соответствующих нервных структур без травматизации окружающих структур и тканей.
Нейростимуляция
Нейростимуляция является современным методом лечения, который представляет собой малоинвазивную нейрохирургическую операцию.
Данный метод применяется в следующих случаях:
- Несмотря на правильно подобранную лекарственную терапию, у пациента не удаётся добиться значительного уменьшения симптомов.
- Прогрессирование заболевания приводит к необходимости увеличивать дозы лекарственных препаратов, при этом побочные эффекты лекарств становятся непереносимыми.
- Пациент социально активен и боится потерять работу из-за заболевания.
- Пациент теряет способность к самообслуживанию и становится зависимым от своей семьи в выполнении повседневных действий.
Суть метода: лечебный эффект достигается за счёт стимуляции точно рассчитанным небольшим по амплитуде электрическим током определённых структур головного мозга, ответственных за контроль над движениями тела. Для этого пациенту вводятся в головной мозг тонкие электроды, которые соединяются с нейростимулятором (похож на кардиостимулятор), имплантирующимся подкожно в области груди под ключицей.
Сама операция обычно проводится в два этапа. На первом этапе под местным обезболиванием с помощью магнитно-резонансной томографии и стереотаксической нейронавигации электроды вводятся в глубинные структуры головного мозга, ответственные за контроль над движениями, — в область субталамического ядра (STN). Затем осуществляется тестовая стимуляция, в ходе которой пациент сообщает о соматосенсорных ощущениях, возникающих при различных параметрах стимуляции. При положительном результате проводится второй этап: пациенту имплантируются подкожные части системы — коннекторы и генератор импульсов (нейростимулятор). Обычно второй этап проводится под наркозом. В послеоперационном периоде производится программирование нейростимулятора и обучение пациента. Пациент имеет возможность сам корректировать настройки стимуляции (в пределах, заданных врачом) в зависимости от собственного самочувствия и особенностей выполняемой деятельности.
Результаты операции:
- Увеличивается период эффективного контроля над симптомами болезни.
- Значительно снижается необходимость в антипаркинсонических лекарствах.
- Позволяет неинвазивно корректировать настройки стимуляции при прогрессировании заболевания.
- В отличие от палидотомии и таламотомии, является обратимой.
- Может быть билатеральной (то есть эффективна и при симптомах с обеих сторон тела).
- Легко переносится и является безопасным методом
Недостатки нейростимуляции:
- Относительно высокая стоимость.
- Вероятность смещения электродов или поломки; в этих случаях (15 %) нужна повторная операция
- Необходимость замены генератора (через 3-7 лет)
- Некоторый риск инфекционных осложнений (3-5 %)
Лечение с применением стволовых клеток. Генная терапия
Результаты первых испытаний по применению стволовых клеток при болезни Паркинсона были опубликованы в 2009 году. Согласно полученным данным, через 36 месяцев после введения стволовых клеток положительный эффект отмечен у 80 % больных. Лечение заключается в трансплантации нейронов, полученных в результате дифференцировки стволовых клеток, в головной мозг. Теоретически они должны заменить погибшие дофаминсекретирующие клетки. Метод на вторую половину 2011 года исследован недостаточно и не имеет широкого клинического применения.
Новый метод лечения, направленный на остановку болезни Паркинсона — пересадка пациенту собственных стволовых клеток (перепрограммированных его клеток кожи), дифференцированных в предшественники дофаминергических нейронов. В США с 2017 года первый пациент начал получать такую терапию (бывший врач Джордж Лопес, финансирующий эти исследования). В результате лечения на 2020 год нейродегенерация в его мозге приостановилась, а работоспособность улучшилась, субъективно улучшилось качество жизни. Пока что такая терапия остаётся единичной, из-за этических вопросов каждый раз необходимо получать разрешение регулирующего органа (FDA).
В 2003 году впервые человеку с болезнью Паркинсона в субталамическое ядро были введены генетические векторы, содержащие ген, ответственный за синтез глутаматдекарбоксилазы. Данный фермент снижает активность субталамического ядра. Вследствие этого он оказывает положительное терапевтическое воздействие. Несмотря на полученные хорошие результаты лечения, на первую половину 2011 года методика практически не применяется и находится в стадии клинических исследований.
Перспективы растворения телец Леви
Многими исследователями считается, что тельца Леви являются не просто маркером болезни Паркинсона, но и одним из патогенетических звеньев, то есть усугубляют симптомы. В исследованиях Assia Shisheva 2015 года показано, что агрегацию α-синуклеина с образованием телец Леви предотвращает комплекс белков ArPIKfyve и Sac3., который даже может способствовать расплавлению этих патологических включений. На основе указанного механизма появляется перспектива создания лекарства, способного растворять тельца Леви и лечить ассоциированные с ними деменции.
Исследования на животных
Для изучения этиологии и патогенеза болезни Паркинсона, а также для разработки новых методов лечения широко используются «модели» данной болезни, вызываемой у животных. В качестве модельных животных обычно используются генетически модифицированные линии мышей [1] и обезьяны — макаки-резусы [2] и мармозетки. У обезьян симптомы болезни обычно вызывают с помощью 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP) или 6-гидроксидопамина (6-OHDA). Были также получены трансгенные обезьяны с избирательной сверхэкспресией в мозге α-синуклеина, что вызывало развитие симптомов болезни Паркинсона.
В 2020 году проведено успешное устранение симптомов болезни Паркинсона у модельных мышей путём блокировки синтеза полипиримидин-связывающего белка (PTB1) в астроцитах, в результате чего делящиеся астроциты были перепрограммированы в нейроны. Сможет ли такое репрограммирование остановить развитие болезни Паркинсона у людей, неизвестно. Есть также данные о том, что устранить симптомы болезни Паркинсона у модельных мышей позволяет лечение фарнезолом.
Клинические испытания
С 2011 года проводится серия клинических испытаний вакцины PD01. Предполагается, что PD01 блокирует выработку α-синуклеина за счёт выработки специфичных антител. У всех добровольцев первой группы получавших препарат, удалось добиться стабилизации состояния. У 50 % испытуемых обнаружены антитела к α-синуклеину. Клинические испытания должны закончиться в 2016—2017 годах.
Кетогенная диета обладает потенциальным терапевтическим эффектом благодаря своим нейрозащитным и противовоспалительным свойствам. В пилотном исследовании 2019 года значительные когнитивные улучшения у пациентов были обнаружены уже после 8 недель на диете.
В январе 2019 года пресс-служба университета Мельбурна сообщила о результатах испытания препарата для лечения болезни Паркинсона, БАС и старческой деменции, разработка которого велась на протяжении 15 лет. Сообщается, что у 70 % пациентов, прошедших экспериментальное лечение препаратом CuATSM, отмечалось стойкое и существенное замедление развития заболевания двигательных нейронов и улучшение когнитивных и клинических симптомов. Второй этап клинических испытаний назначен на 2019 год.
В феврале 2019 года был опубликован отчёт о завершившихся клинических испытаниях проводившихся при участии Бристольского университета в Великобритании. 41 доброволец принимал участие в двойном слепом рандомизированном плацебо-контролируемом исследовании 2-й фазы. Испытуемым вводили препарат нейротрофина — глия-производного нейротрофического фактора (GDNF) — под напором непосредственно в обе половины стриатума головного мозга с помощью четырёх ультратонких катетеров. Эксперимент проводился в течение 18 месяцев. В первые 9 месяцев испытуемые случайным образом были разделены на две группы: одна группа получала инъекции GDNF, а вторая — плацебо. Во второй части эксперимента все испытуемые получали препарат. Несмотря на то, что состояние большинства участников улучшилось, в ходе первой части эксперимента не удалось достичь у первой группы требуемого 20 % порога улучшения по сравнению с группой получавшей плацебо (по неизвестной причине в случае болезни Паркинсона применение плацебо даёт существенный положительный эффект). Тем не менее, результаты МРТ продемонстрировали заметное восстановление количества нейронов в указанной области головного мозга испытуемых. Таким образом, отмечали авторы эксперимента, улучшение «выходит далеко за пределы всего когда-либо виденного в ходе исследований, посвящённых лечению болезни Паркинсона с помощью факторов роста, доставляемых хирургическим путём». Дальнейшие исследования показали, что увеличенные дозы препарата, а также увеличенное время наблюдения могут дать более чёткие результаты в зависимости от стадии болезни пациентов.
Прогноз

Прогноз условно неблагоприятный — болезнь Паркинсона неуклонно прогрессирует. Симптомы нарушения движений развиваются наиболее быстро. Больные, не получающие лечения, в среднем теряют возможность обслуживать себя самостоятельно через 8 лет от начала заболевания, а через 10 лет становятся прикованными к постели. На вторую половину 2011 года подавляющее большинство пациентов получает соответствующее лечение. Прогноз в данной группе лучше, по сравнению с больными, не получающими адекватной терапии. Лица, принимающие леводопу, становятся зависимыми от обслуживающих их лиц в среднем через 15 лет. Тем не менее, в каждом конкретном случае скорость прогрессирования заболевания различна. Отмечено, что при относительно раннем развитии болезни Паркинсона быстрее всего прогрессируют симптомы нарушения двигательной активности, а при появлении первых симптомов заболевания у лиц 70 лет и старше на первый план выходят психические расстройства.
Адекватная терапия замедляет развитие ряда симптомов, ведущих к потере трудоспособности больных (мышечной ригидности, гипокинезии, постуральной неустойчивости и др.). Однако через 10 лет с момента начала заболевания трудоспособность большинства больных значительно снижена.
Продолжительность жизни больных снижена. Трудоспособность у данных больных стойко и необратимо утрачивается, в зависимости от выраженности неврологических нарушений больным назначается группа инвалидности.
Известные люди, ставшие жертвами болезни Паркинсона
Болезнь поражает людей самых разнообразных социальных групп и профессий. Развиваясь постепенно, она приводит к снижению трудоспособности больного человека.
Данное заболевание было диагностировано у некоторых знаменитых политиков, государственных и церковных деятелей. Диагноз болезни Паркинсона был поставлен папе римскому Иоанну Павлу II в 1993 году. Официально Ватиканом болезнь понтифика признана в 2003. Таким образом Иоанн Павел II последние 12 лет жизни страдал от симптомов и проявлений паркинсонизма. В последние годы жизни китайский государственный деятель Мао Цзэдун отошёл от политической деятельности в связи с развившимся у него недугом. У палестинского лидера Ясира Арафата болезнь Паркинсона официально признана не была. Однако наличие у него выраженного тремора в последние годы жизни дало основание предполагать данное заболевание. Болезнь Паркинсона диктатора Франсиско Франко в значительной степени повлияла на историю Испании. По воспоминаниям короля Хуана Карлоса «Франко был человеком, созданным чтобы прожить 100 лет. Не курил, не пил и не был большим гурманом. Вёл совершенно размеренную жизнь и проводил много времени на воздухе, охотясь или ловя рыбу с борта „Асор“». Болезнь стала для него большой неожиданностью. Франко дал поручение подготовить декрет о передаче власти и в 1973 году ушёл с поста председателя правительства.

Среди представителей искусства и научного мира болезнь Паркинсона была диагностирована у Сальвадора Дали, знаменитого итальянского и советского физика Бруно Понтекорво, математика Андрея Колмогорова, британского писателя Артура Кёстлера, советского и российского поэта Андрея Вознесенского, британских рок-музыкантов Гленна Типтона и Оззи Осборна, R&B музыканта, создателя группы Earth, Wind & Fire Мориса Уайта. Испанскому живописцу и скульптору Сальвадору Дали диагноз был поставлен за 8 лет до смерти, в 1981 году. У британского писателя Артура Кёстлера симптомы болезни появились в 1976 году. Несмотря на то, что сильный тремор в руках мешал ему писать, он ещё создал несколько произведений. Поэт-шестидесятник Андрей Вознесенский после 15 лет заболевания умер от его осложнений. В возрасте 101 год умер от осложнений болезни Паркинсона Жак Фреско, американский производственный инженер, промышленный дизайнер и футуролог.
Заболеванию также подвержены спортсмены. Развитие болезни Паркинсона приводит к их уходу из профессионального спорта. В неполные 40 лет у американского боксёра Мохаммеда Али диагностировали болезнь Паркинсона. Многократный чемпион был вынужден завершить свою спортивную карьеру. Боролся с болезнью 35 лет, в возрасте 74 лет умер. К другим знаменитым спортсменам-паркинсоникам можно отнести американского автогонщика Фила Хилла и баскетболиста Брайана Гранта.
Среди знаменитых киноактёров болезнь Паркинсона была диагностирована у Майкла Джей Фокса, Деборы Керр, Винсента Прайса и Робина Уильямса. Советский и российский актёр Михаил Ульянов страдал заболеванием последние 15 лет жизни. У американо-канадского актёра Майкла Джей Фокса болезнь была диагностирована в 1991 году. Ему на тот момент было всего 30 лет. Впоследствии он создал общественную организацию «Фонд Майкла Джей Фокса» по исследованию болезни Паркинсона, которая помогает паркинсоникам и спонсирует исследования по изучению проблемы. Самому Фоксу была проведена таламотомия.
В 2016 году болезнь Паркинсона была выявлена у знаменитого российского модельера Вячеслава Зайцева.
Высказывалось предположение, что болезнью Паркинсона страдает президент Российской Федерации Владимир Путин.
См. также
Литература
- Болезнь Паркинсона // Нейродегенеративные заболевания: учеб. пособие / Сост.: Р.В. Магжанов, К.З. Бахтиярова, Е.В. Первушина. — Уфа: ФГБОУ ВО БГМУ Минздрава России, 2018. — С. 31-50. — 96 с.
Ссылки
- Национальное общество по изучению болезни Паркинсона и расстройств движений
- European Parkinson’s Disease Association (EPDA) guidelines
- Болезнь Паркинсона
- Определён ген, вызывающий заболевание Паркинсона.
- Здоровая тема.ru — болезнь Паркинсона на сайте медицинского справочника «Здоровая тема».
- The Parkinson’s Disease Forum (англ.).
- Санкт-Петербургская общественная организация инвалидов, больных болезнью Паркинсона.
- Болезнь Паркинсона, запись с медицинского канала MDTV, c переводом на русский.
- Болезнь Паркинсона — болезнь Паркинсона на сайте о нейродегенеративных заболеваниях «Деменция.com».
- Экологические факторы риска при болезни Паркинсона (на английском языке с Google-переводом)
- Луцкий И. С., Евтушенко С. К., Симонян В. А. Симпозиум «Болезнь Паркинсона (клиника, диагностика, принципы терапии)» // Последипломное образование. — 2011. — № 5 (43).
| ||||





