
Фавипиравир
| Фавипиравир | |
|---|---|
 | |
| Химическое соединение | |
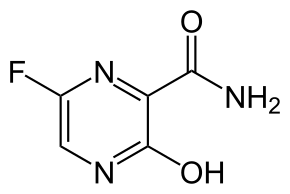
| ИЮПАК | 6-фторо-3-гидроксипиразин-2-карбоксамид |
| Брутто-формула | C5H4FN3O2 |
| Молярная масса | 157,104 г/моль |
| CAS | 259793-96-9 |
| PubChem | 492405 |
| DrugBank | 12466 |
| Состав | |
| Классификация | |
| АТХ | J05AX27 |
| Способы введения | |
| перорально | |
| Другие названия | |
| Фавилавир, Авифавир, Авиган, Арепливир, Коронавир, T-705 | |
Фавипирави́р — нуклеозидный аналог, разработанный японской компанией FUJIFILM Toyama Chemical Co., Ltd. в 2002 году
Срок патента на фавипиравир истек в 2019 году. С 2021 года в некоторых странах препарат исследуется на применимость против гриппа и других заболеваний.
Препарат лицензирован в Японии для лечения только атипичного (несезонного) гриппа в условиях новых пандемий, в клинической практике он там не применялся.
В подавляющем большинстве стран мира фавипиравир не используется для лечения COVID-19. В России фавипиравир включён в рекомендации по лечению COVID-19 и в список жизненно необходимых и важнейших лекарственных препаратов Минздрава России.
В июле 2020 года результаты клинических испытаний в Японии препарата по лечению COVID-19, по словам самого исследователя Yohei Doi, «не достигли статистической значимости»; несмотря на это, Минздрав РФ уже одобрил его для использования в этом качестве.
На конец 2021 года доказано, что фавипиравир неэффективен для лечения COVID-19, не сокращает время до клинического выздоровления и продолжительность пребывания в стационаре. Не превосходит другие противовирусные препараты, вызывая при этом более тяжёлые симптомы, больше сопутствующих заболеваний, больше осложнений, а также неэффективен при контроле цитокинового шторма.
Мутагенное действие фавипиравира несет угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату.
До получения международного непатентованного названия фавипиравир обозначался индексом разработчика T-705. Фавипиравир продаётся под торговыми марками Avigan (アビガン, Abigan), Avifavir, Areplivir, FabiFlu и Favipira.
Содержание
Фармакологические свойства
Фармакодинамика
In vitro фавипиравир обладает широким спектром активности против РНК-содержащих вирусов, включая вирусы гриппа, риновирус, респираторно-синцитиальный вирус, а также опасных для жизни вирусов. Не работает против ДНК-содержащих вирусов, в числе которых аденовирус, вирус простого герпеса первого типа и цитомегаловирус.
Механизм действия
О механизме действия фавипиравира есть разные мнения. Одни исследователи считают, что фавипиравир селективно ингибирует вирусную РНК-зависимую РНК-полимеразу. Другие исследования показывают, что фавипиравир индуцирует летальные мутации РНК-трансверсии, производя нежизнеспособный вирусный фенотип путём терминирования удлинения формирующейся цепи РНК.
Также есть мнение, что фавипиравир как в пероральной, так и внутривенной формах является пролекарством, которое метаболизируется до его активной формы, фавипиравир-рибофуранозил-5'-трифосфат (фавипиравир-RTP). Считается, что человеческая гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT) играет ключевую роль в процессе его активации.
Применение в медицине
К 2020 году фавипиравир был одобрен только в Японии исключительно для лечения атипичного гриппа, то есть был показан только для нового гриппа (штаммы, вызывающие более тяжёлые заболевания), а не для сезонного гриппа. Однако, фактически, на практике не применялся. По состоянию на 2020 год вероятность развития резистентности представляется низкой.
В России фавипиравир включен в рекомендации по лечению COVID-19, несмотря на несогласия экспертов и учёных, некоторые из которых заявляли об этом как о "преступлении против здоровья россиян".
Побочные эффекты
Ранние исследования показали проаритмогенное действие этого препарата при лечении лихорадки Эбола.
Фавипиравир токсичен при беременности и планировании беременности, он способен нарушить эмбриональное развитие плода. Исследования, опубликованные в 2020 году, показали, что фавипиравир оказывает тератогенное и эмбриотоксическое действие, вследствие чего его использование противопоказано у беременных женщин. Также он оказывает влияние на морфогенез сперматозоидов. Из-за этого в 2019 году японское агентство по лекарственным средствам включило в инструкцию к фавипиравиру предупреждение о необходимости обязательного применения барьерной контрацепции во время терапии и в течение как минимум 7 дней после её окончания мужчинами, получающими препарат. У женщин фертильного возраста необходимо обязательное проведение теста на беременность перед назначением фавипиравира и соблюдение эффективной контрацепции. Частым осложнением терапии фавипиравиром у пациентов с COVID-19 являлось увеличение концентрации мочевой кислоты в крови вплоть до 2,5 раз — гиперурикемия, гиперчувствительность, диарея, нейтропения, лейкопения, гипертриглицеридемия и гипертрансаминаземия. К числу побочных эффектов препарата также относятся фибрилляция предсердий, тошнота, рвота, головная боль, головокружение, сыпи, боль в груди, лейкоцитоз, моноцитоз, ретикулоцитопения, глюкозурия, гипокалиемия, повышение активности щелочной фосфотазы, повышение концентрации билирубина в крови, боль в животе, аномальное поведение, повышение активности креатинфосфокиназы, гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечеткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке, язва двенадцатиперстной кишки, кровянистый стул, гастрит, бронхиальная астма, боль в горле, ринит, назофарингит, экзема, зуд, астения, энантема, запор, глоссит, развитие злокачественного нейролептического синдрома. Известны случаи острого приступа подагрического артрита.
Препарат противопоказан при печёночной недостаточности тяжёлой степени (класс С по Чайлд-Пью), повышенной чувствительности к фавипиравиру, почечной недостаточности тяжелой и терминальной степени тяжести (СКФ <30 мл/мин); беременности или планировании беременности; в период грудного вскармливания; детский возраст до 18 лет. Вероятно, вызывает холестатическое поражение печени.
Приём фавипиравира во время беременности может нанести вред будущему ребёнку. Эксперименты на 4 видах животных показали замедленное развитие эмбриона и его смерть в первом триместре, однако исследования на людях, включающие беременных или кормящих женщин, отсутствуют. В связи с риском тератогенности Японское бюро по безопасности лекарственных средств (англ. Pharmaceuticals and Medical Devices Agency) ввело строгие ограничения для использования препарата среди женщин репродуктивного возраста и предписало производителю указывать предупреждение об этом на упаковках и в инструкциях. Фавипиравир разрешено использовать в Японии только при отсутствии альтернатив.
Фавипиравир обнаруживается в грудном молоке, при использовании препарата грудное вскармливание должно быть приостановлено .
Пациентам до 18 лет препарат противопоказан, поскольку не изучен в клинических исследованиях.
Группы высокого риска развития побочных эффектов: пожилые пациенты, пациенты с нарушениями вестибулярного аппарата, пациенты, управляющие транспортными средствами и работающие с механизмами.
На основе заключения Японского агентства по лекарственным средствам, в последний пересмотр инструкции к оригинальному японскому препарату «Авиган» включено предупреждение о нежелательных эффектах в виде неспецифических моторных нарушений, способных привести к падениям.
Вызывает лекарственную лихорадку в некоторых случаях.
В 2021 году исследования показали, что применение фавипиравира несет угрозу появления новых опасных вирусных штаммов с повышенной патогенностью для человека и животных и приобретённой устойчивостью к химиопрепарату.
Другие исследования также показали, что фавипиравир вызывает значительное повышение мочевой кислоты в крови и обратно пропорционален уровню ферритина в крови.
Была обнаружена фототоксичность: желто-зеленая флуоресценция на лице, волосах и ногтевых лунках пациентов, принимавших фавипиравир.
В январе 2022 года также стало известно о случаях появления сыпи, отеков, включая ангионевротический отек (отек Квинке) у пациентов при пероральном применении фавипиравира.
Также наблюдались одновременно лейкопения и повышение уровня креатинина у пациентов с почечными трансплантантами.
В сочетании с метотрексатом приводил к гепатотоксичности. C пиразинамидом — к гиперурикемии (дополнительно повышается реабсорбция мочевой кислоты в почечных канальцах). С репаглинидом — может повыситься концентрация репаглинида в крови, возможно развитие нежелательных реакций на репаглинид (ингибирование CYP2C8 приводит к повышению концентрации репаглинида в крови). С теофиллином — концентрация фавипиравира в крови может повыситься, возможно развитие нежелательных реакций на фавипиравир (взаимодействие с ксантиноксидазой может привести к повышению концентрации фавипиравира в крови). С фамцикловиром, сулиндаком — эффективность данных препарата может быть снижена (ингибирование фавипиравиром альдегидоксидазы может привести к снижению концентрации активных форм данных ЛС в крови).
Стал известен случай транзиторной синусовой брадикардии, вызванной фавипиравиром.
Известны смертельные случаи пациентов на фоне терапии фавипиравиром.
История
Фавипиравир разработан в 2002 году японской компанией FUJIFILM Toyama Chemical Co., Ltd.. В разработавшей препарат компании Toyama Chemical тогда надеялись, что фавипиравир станет новым лекарством от гриппа, которое может заменить осельтамивир, но эксперименты на животных показали, что он может негативно влиять на ДНК будущего ребёнка с риском повреждения плода, поэтому одобрение данного препарата Министерством здравоохранения, труда и социального обеспечения Японии было отложено на неопределённый срок.
Первые научные публикации о препарате появились в 2002 году.
В 2014 году фавипиравир был одобрен в Японии в качестве препарата против гриппа — ограниченно разрешён для лечения гриппа A и B, вызванного резистентными к противовирусным препаратам штаммами, он не предназначен для лечения сезонного гриппа. По состоянию на 2020 год вероятность развития резистентности вируса гриппа к препарату остаётся низкой.
В Японии после регистрации фавипиравира в клинической практике он не применялся.
15 марта 2020 года препарат был разрешён к продаже в Китае для лечения гриппа. 30 мая 2020 года фавипиравир, выпускаемый под торговым наименованием «Авифавир» на совместном предприятии «ХимРара» и РФПИ, зарегистрирован в России как лекарство от коронавирусной инфекции. До 17 сентября 2020 года фавипиравир в России не был предназначен для продажи в розницу, а разрешён к применению только в условиях стационара. Немецкое правительство также закупило некоторое количество фавипиравира, чтобы поставлять его в клиники по запросам врачей, но спросом у них он не пользуется. Немецкие специалисты отмечают, что в России, относительно европейских стран, ниже требования к клиническим исследованиям, необходимым для сертификации (регистрации) лекарств, а сама процедура регистрации менее строгая, чем у них.
В октябре 2020 года фавипиравир включен в список «Жизненно необходимые и важнейшие лекарственные препараты» (ЖНВЛП) Минздрава РФ.
Фавипиравир исследовался как возможное средство против SARS-CoV-2 (для лечения коронавирусной инфекции COVID-19), попал в руководства по лечению некоторых стран. Он не оправдал ожиданий: в исследовании, выполненном по стандартам доказательной медицины, завершённом в середине 2020 года, значимый терапевтический эффект у него не обнаружен. В 2021 году завершилось другое исследование фавипиравира при лечении COVID-19, в котором клинический эффект этого препарата не был обнаружен. Проводившая исследование канадская компания Appili Therapeutics, ранее вступившая в консорциум производителей фавипиравира, опубликовала заявление, в котором признала ошибочность своих надежд на эффективность фавипиравира, прекратила финансирование проектов по фавипиравиру и пообещала сосредоточиться на разработках других лекарств против COVID-19.
В 2020 году фавипиравир зарегистрирован в России и включен в список жизненно необходимых и важнейших лекарственных препаратов Минздрава России, несмотря на то, что в доклинических исследованиях, он показал способность оказывать тератогенное и эмбриотоксическое действие, а также влияние на морфогенез сперматозоидов.
На 2020 год Фавипиравир изучается как потенциальное средство для лечения ряда других вирусных инфекций.
Правовой статус
Министерство обороны США разработало фавипиравир в партнёрстве с MediVector, Inc. в качестве противовирусного препарата широкого спектра действия и спонсировало его в рамках клинических испытаний фазы II и III FDA, в которых он продемонстрировал безопасность для людей и эффективность против вируса гриппа. Несмотря на демонстрацию безопасности более чем у 2000 пациентов и ускорение выведения вируса гриппа на 6–14 часов в неопубликованных исследованиях фазы III, фавипиравир по-прежнему не одобрен в Великобритании и США. В 2014 году Япония одобрила фавипиравир для лечения штаммов гриппа, не реагирующих на современные противовирусные препараты. Первоначально компания Toyama Chemical надеялась, что фавипиравир станет новым лекарством от гриппа, которое сможет заменить осельтамивир (торговая марка Тамифлю). Однако эксперименты на животных показывают потенциал тератогенных эффектов, и одобрение производства Министерством здравоохранения, труда и социального обеспечения было сильно задержано, а условия производства ограничены только в случае чрезвычайной ситуации в Японии.
Из-за пандемии COVID-19 фавипиравир был быстро одобрен в Китае в феврале 2020 года для розничной продажи.
20 июня 2020 года препарат был вначале одобрен в Индии для лечения пациентов с COVID-19 под торговой маркой Fabiflu, однако 11 апреля 2022 года его исключили из списка препаратов для лечения Covid-19.
В России
29 мая 2020 года первый препарат фавипиравира зарегистрирован Минздравом РФ.
30 мая 2020 года Минздрав России зарегистрировал дженерик фавипиравира под названием «Авифавир».
25 июня 2020 года Минздрав России одобрил второй препарат фавипиравира — «Арепливир».
С июня-июля 2020 года фавипиравир доступен в России под торговыми марками «Авифавир», «Арепливир», «Коронавир» и «Фавибирин».
Эффективность и безопасность
В 2009 году фавипиравир считался нетоксичным для млекопитающих, поскольку он не ингибирует синтез их собственных РНК или ДНК. Инструкции к российским препаратам фавипиравира приводят данные об ингибировании β- и γ- ДНК-полимераз человека, а также полимеразы II РНК человека. На 2014 год некоторые стандартныетесты на генотоксичность (способность вызывать мутации/повреждения ДНК) на клетках и на животных дали положительный результат, однако эти результаты были объяснены непрямыми эффектами, и риск генотоксичности фавипиравира считался низким.
На 2020 год утверждения об эффективности фавипиравира при лечении любых болезней людей ничем не обоснованы, на август-октябрь 2021 года для него также нет доказательств эффективности.
Из-за тератогенности и эмбриотоксичности для животных фавипиравир противопоказан беременным женщинам.
На конец 2021 года доказано, что фавипиравир неэффективен для лечения COVID-19 , а его мутагенное действие несет угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату.
По данным живого систематического обзора с метаанализом безопасность лечения фавипиравиром не отличается от стандартной терапии
Исследования
Препарат показал активность против многих вирусов в лабораторных условиях in vitro и некоторую эффективность в испытаниях на животных. На людях испытывался против опасных для жизни вирусов лихорадок Эбола и Ласса, вирусов бешенства и тяжелой лихорадки с синдромом тромбоцитопении. Пока отсутствуют штаммы, выработавшие устойчивость к препарату.
При выдаче разрешения на ограниченное использование в Японии в 2014 году PMDA указало на отсутствие полного спектра исследований препарата и предписало производителю провести их и опубликовать результаты.
В 2014 году некоторые исследователи высказывали предположение о потенциале фавипиравира для лечения геморрагической лихорадки Эболы. Но проведённое впоследствии клиническое исследование в Гвинее имеет серьёзные недостатки методики и ничего не доказывает.
К середине 2020 года были завершены 14 клинических испытаний фавипиравира как лекарства для лечения разных заболеваний, при этом результаты опубликованы только в одном испытании 2 фазы и одном — третьей, у 12 исследований результаты недоступны для анализа. В одном исследовании второй фазы показано, что препарат клинически эффективен против вирусов гриппа, при этом отсутствовали смертность и серьёзные побочные эффекты. В другом исследовании (третьей фазы) сделан вывод, что препарат может облегчать симптомы и снижать лихорадку.
Ретроспективный анализ спонтанных сообщений о нежелательных реакциях при применении лекарственных средств (ЛС) для лечения COVID-19 в период с 28.04.2020 по 11.07.2021, зарегистрированных в национальных базе РФ (АИС РЗН), показал следующее распределение сообщений по ЛС : фавипиравир – 96, олокизумаб – 86, гидроксихлорохин – 77, лопинавир + ритонавир – 52, азитромицин – 46, тоцилизумаб – 29, мефлохин – 4 и барицитиниб – 3.
COVID-19
Фавипиравир изучался в качестве потенциального средства лечения COVID-19 с февраля 2020. В апреле 2020 года специалисты ВОЗ отложили обсуждение включения фавипиравира в исследование Solidarity из-за недостаточности доказательств его эффективности.
В июле 2020 года, после завершения клинического испытания на 89 пациентах, японские исследователи в интервью сообщили, что не смогли обнаружить у фавипиравира терапевтический эффект при лечении им COVID-19.
В исследовании по стандартам доказательной медицины, завершившемся в Японии в 2020 году, значимый эффект применения фавипиравира в лечении COVID-19 не обнаружен.
Статья египетских исследователей, опубликовавших выводы о фавипиравире как о безопасной эффективной альтернативе гидроксихлорохину у пациентов с COVID-19 легкой или средней степени тяжести, была позднее отозвана редакцией и признана фальсификацией.
На ноябрь 2021 года, по данным исследования PRESECO, фавипиравир не ускоряет выздоровление пациентов с COVID-19. Проводившая исследование канадская биотехнологическая компания признала его бесперспективным против COVID-19.
Семь систематических обзоров, подкрепленных метаанализами, выявили очень слабую доказательную базу в отношении терапевтической эффективности фавипиравира, указывая на то, что в целом он не несет особой пользы для пациентов при лечении COVID-19.
По состоянию на июль 2022 года фавипиравир не имеет доказательств эффективности по критериям сокращения летальности и риска ИВЛ. По данным низкой достоверности, фавипиравир может снижать время до клинического выздоровления (разрешения симптомов), а также срок госпитализации при COVID-19.
Эбола
Клинические испытания по изучению использования фавипиравира против болезни, вызванной вирусом Эбола, начались в гвинейском Гекеду, в декабре 2014 года. Предварительные результаты, представленные в 2016 году на Конференции по ретровирусам и оппортунистическим инфекциям (CROI), опубликованные позднее, показали снижение смертности у пациентов уровень вируса в крови от низкого до среднего, но не влияет на пациентов с высоким уровнем (группа с более высоким риском смерти). Это исследование недостоверно из-за его дизайна — использовался только исторический контроль.
Критика
"По сути, фавипиравир — это яд, поэтому его не стали массово применять против вируса гриппа (прим.: в Японии)" — считает руководитель лаборатории геномной инженерии МФТИ к.б.н. Павел Волчков. Применение фавипиравира для легких и среднетяжелых форм, как это прописано в инструкциях к разрешенным отечественным «Коронавиру» и «Арепливиру», неоправданно, уверен Павел Волчков.
Доктор медицинских наук Василий Власов, профессор НИУ ВШЭ, выступил против применения этого препарата для терапии COVID-19, выразил свои сомнения в эффективности этого препарата и дженериков на его основе.
О. П. Жирнов и А. И. Чернышова указывают, что мутагенное действие фавипиравира несет угрозу появления новых опасных вирусных штаммов, в том числе с повышенной патогенностью и с повышенной устойчивостью к препарату.
Оказался самым худшим по сравнению с другими ЛС с точки зрения побочных эффектов.
Литература
- Khambholja, K. Potential repurposing of Favipiravir in COVID-19 outbreak based on current evidence : [англ.] / Kapil Khambholja, Deepak Asudani // Travel Medicine and Infectious Disease. — 2020. — Vol. 35. — P. 101710. — 2 p. — ISSN 1477-8939. — doi:10.1016/j.tmaid.2020.101710. — PMID 32360327. — PMC 7252084.
- Report on the deliberation results – avigan : [англ.] / Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau. — Japan : Pharmaceuticals and Medical Devices Agency, 2011. — 172 p.
Документы
- Регистрационное удостоверение ЛП-006225 : Авифавир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 29 мая.
- Регистрационное удостоверение ЛП-006288 : Арепливир // Государственный реестр лекарственных средств. — Минздрав РФ, 2020. — 23 июня.
- Блинов, А. А. Инструкция по медицинскому применению лекарственного препарата Авифавир : ЛП-006225-290520 / ООО «Кромис». — Министерство здравоохранения Российской Федерации, 2020. — 29 мая. — 8 с.
Ссылки
- Drug Name: Favipiravir [USAN:INN:JAN] (англ.). Drug Information Portal. U. S. National Library of Medicine.
