Цитохром c
Цитохром c (англ. cyt c) — небольшой гем-содержащий белок, относится к классу цитохромов, содержит в структуре гем типа c. Выполняет в клетке две функции. С одной стороны, он является одноэлектронным переносчиком, свободно связанным с внутренней мембраной митохондрий, и необходимым компонентом дыхательной цепи. Он способен окисляться и восстанавливаться, но не связывает при этом кислород. С другой стороны, при определённых условиях он может отсоединяться от мембраны, переходить в раствор в межмембранном пространстве и активировать апоптоз. Такая двойственность связана со специфичными свойствами молекулы цитохрома c.
Содержание
Строение и свойства
Цитохром c — небольшой белок с молекулярной массой 12 кДа. В отличие от других цитохромов, является хорошо растворимым белком (растворимость около 100 г/л).
Цитохром c содержит в своей структуре гем типа c, который образует ковалентную связь через остатки цистеина (Cys-14 и Cys-17).
Биосинтез
У человека цитохром c кодируется ядерным геном CYCS.
Цитохром c синтезируется в виде неактивного предшественника — апоцитохрома. Его трансляция и котрансляционная модификация происходят в цитоплазме.
Для дальнейшего созревания апоцитохром и гем b (Fe-протопорфирин IX) должны транспортироваться в межмембранное пространство митохондрий.
Шапероны гема часто вовлечены в процесс доставки гема b в межмембранное пространство.
Импорт апоцитохрома через внешнюю мембрану отличается от обычного белкового транспорта в митохондрии. В этот процесс вовлечен белок холоцитохром-c-синтаза (HCCS, другое название гем-лиаза), который одновременно присоединяет гем к апоцитохрому. При этом цитохром принимает более компактную струкутуру и становится активным. Важно, что перед ковалентным присоединением железо гема должно быть восстановлено, а цистеины апоцитохрома - окислены. Окисление цистеинов с формированием дисульфидной связи осуществляет фермент тиол-дисульфид-оксидоредуктаза.
Биосинтез цитохрома отличается у разных организмов, и до сих пор нет общепринятой номенклатуры белков, принимающих участие в этом процессе.
Функции
Основная функция цитохрома c — перенос электронов между комплексами III (кофермент Q — Cyt C редуктаза или Цитохром-bc1-комплекс) и IV (Цитохром c-оксидаза) дыхательной цепи митохондрий. Кроме того, цитохром c вызывает апоптоз (запрограммированную клеточную гибель) при выходе из митохондрий в цитоплазму, служит для усиления сигнального пути апоптоза, а также имеет ряд неапоптотических функций.
Дыхание
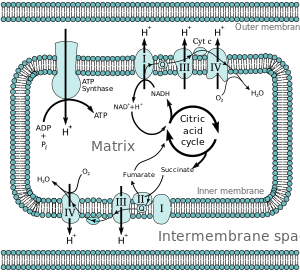
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, который происходит на внутренней мембране митохондий при участии пяти комплексов дыхательной цепи. Он заключается в последовательном переносе электронов между комплексами с субстрата на молекулу кислорода, сопряженном закачивании протонов в межмембранное пространство и синтезе АТФ за счет полученного потенциала протонов. Для этого процесса необходимы переносчики электронов, которые работают как челноки между дыхательными комплексами. Переносчики электронов могут быть жирорастворимыми, мембранными, или водорастворимыми, но связанными с мембраной. Цитохром c является водорастворимым, связанным с мембраной переносичиком электронов.
Цитохром c принимает один электрон от III комплекса. При этом он восстанавливает свою группу гема.
Далее восстановленный цитохром диффундирует по поверхности мембраны к IV комплексу. Этот комплекс является цитохром c-оксидазой, он принимает электрон у цитохрома и затем переносит накопленные электроны на молекулу O2 с образованием молекулы H2O.
Суммарно процесс выглядит следующим образом: III комплекс катализирует перенос 2 электронов с убихинона на 2 молекулы цитохрома, при этом выкачивая 2 протона из матрикса; IV комплекс катализирует перенос 4 электронов с 4 молекул цитохрома на O2, при этом выкачивая 4 протона из матрикса.
Апоптоз
Роль цитохрома c в апоптозе впервые была обнаружена в экспериментах, где добавление дезоксиаденозинтрифосфата к экстрактам цитозоля вызывало появление активности каспаз, причем без цитохрома активность не развивалась. Позже была показана связь каспазной активности с митохондриями и роль цитохрома как главного посредника. Оказалось, что даже микроинъекции цитохрома в клетки млекопитающих вызывают апоптоз.
Цитохром c принимает участие в развитии как внутреннего, так и внешнего апоптоза. Внутренний (intrinsic) апоптоз запускается повреждениями ДНК, метаболическим стрессом или присутствием неправильно свёрнутых белков. Ключевой этап в развитии внутреннего апоптоза — пермеабилизация внешней мембраны митохондрий. Внешний (extrinsic) апоптоз запускается при присоединении внеклеточного лиганда к мембранному рецептору клетки.
При активации апоптоза цитохром выходит из межмембранного пространства митохондрий в цитоплазму и связывается с фактором активации апоптотической протеазы (Apaf-1). В итоге выход цитохрома c в цитоплазму инициирует формирование апоптосомы.
Другие функции
Цитохром c способен катализировать гидроксилирование и окисление ароматических углеводородов.
Показана роль цитохрома как антиоксиданта. Он способен катализировать окисление супероксид-радикалов в молекулярный кислород.
Цитохром c катализирует амидирование жирных кислот. Это приводит к образованию важных физиологических регуляторов.
При измененной, частично развернутой конформации цитохром c проявляет пероксидазную активность и увеличивает окисление кардиолипина.
Представленность у разных видов
Цитохром c является консервативным белком, найденным у растений, животных и многих простейших. Это свойство, вместе с небольшим размером, делает цитохром c полезным для исследований в области кладистики.
Первичная структура цитохрома c представлена одной цепью из примерно 100 аминокислотных остатков. У многих высокоорганизованных организмов в цепи ровно 104 остатка. У млекопитающих первичная последовательность цитохрома c отличается лишь по нескольким остаткам. Например, последовательность цитохрома c человека идентична таковой шимпанзе, но отличается от лошади.
Классификация
В свою очередь, среди цитохромов c выделяют четыре класса (класс 1, класс 2, класс 3, класс 4), представители которых отличаются друг от друга белковой частью, числом гемов, лигандами в пятом и шестом координационных положениях железа в геме и, следовательно, обладают сильно отличающимися свойствами.