
Фтороводород
| Фтороводород | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Фтороводород | ||
| Традиционные названия | фтористый водород, гидрофторид; водорода фторид | ||
| Хим. формула | HF | ||
| Рац. формула | HF | ||
| Физические свойства | |||
| Состояние | газ или подвижная жидкость | ||
| Молярная масса | 20,01 г/моль | ||
| Плотность | 0,99 г/см³ | ||
| Энергия ионизации | 15,98 ± 0,01 эВ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −83,4 °C | ||
| • кипения | 19,54 °C | ||
| Критическая точка | 188 | ||
| Энтальпия | |||
| • образования | −273,3 кДж/моль | ||
| Давление пара | 783 ± 1 мм рт.ст. | ||
| Химические свойства | |||
Константа диссоциации кислоты 
|
3,17 | ||
| Растворимость | |||
| • в воде | 72,47 (20 °C) | ||
| Классификация | |||
| Рег. номер CAS | 7664-39-3 | ||
| PubChem | 14917 | ||
| Рег. номер EINECS | 231-634-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW7875000 | ||
| ChEBI | 29228 | ||
| ChemSpider | 14214 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| ЛД50 | 14,3 мг/кг (крысы, внутривенно) | ||
| Токсичность | Чрезвычайно ядовит, СДЯВ | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фтóроводоро́д (гидрофтори́д, фтóристый водорóд, фтори́д водорóда, HF) — бесцветный газ (при стандартных условиях) с резким неприятным запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF. Токсичен, ПДКр.з. = 0,5 мг/м³, II класс опасности (высокоопасные вещества) в соответствии с ГОСТ 12.1.007-76.
Содержание
Строение молекулы
Молекула фтороводорода сильно полярна, μ = 0,19 Д. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 41,5 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
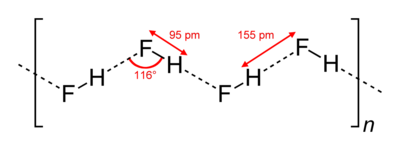
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные цепи с углом HFH = 140° имеют и полимеры HF, существующие в газовой фазе.
Свойства
Физические свойства
- Критическая температура фтористого водорода 188 °C, критическое давление 64 атм.
- Теплота испарения жидкого HF в точке кипения составляет лишь 7,5 кДж/моль (примерно в 6 раз меньше, чем у воды при 20 °C). Это обусловлено тем, что само по себе испарение мало меняет характер ассоциации фтористого водорода (димерная форма, характерная для жидкости, сохраняется и в парах — в отличие от фазового перехода воды).
- Диэлектрическая проницаемость жидкого фтористого водорода (84 при 0 °C) очень близка к значению д.п. для воды.
Химические свойства
- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
- Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
- В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5:
- Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
- Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
- При условии, если фтороводород в газообразном состоянии:
- При условии, если фтороводород в виде водного раствора:
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
-
- Kd= 7,2⋅10−4
-
- Kd= 5,1
-
- Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все растворимые соли плавиковой кислоты очень ядовиты (в больших дозах).
Получение
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Токсикология
Фтористый водород (гидрофторид) обладает резким запахом, очень ядовит, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей. Фтороводород обладает слабыми наркотическими свойствами.
Как и некоторые другие производные фтора, HF высокоопасен в обращении.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применение
Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления). Необычная растворимость биологических молекул в жидком фтороводороде без разложения (напр., белков) используется в биохимии. Добавление в жидкий фтороводород акцепторов фтора позволяет создавать сверхкислые среды.
Интересные факты
- Известный писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
- Фтороводород реагирует со стеклом, поэтому он хранится в пластмассовых ёмкостях. При хранении фтороводорода в стеклянной посуде прибегают к покрытию стекла парафином для защиты его от фтороводорода.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.
| В библиографических каталогах |
|---|
|
HF DF |
|||||||||||||||||
| LiF | BeF2 | BF3 | CF4 |
N2F2 N2F4 NF3 NH4F |
O4F2 O2F2 OF2 |
F | |||||||||||
| NaF | MgF2 | AlF3 |
SiF2 Si3F8 Si4F10 SiF4 |
PF3 PF5 |
S2F2 SF4 S2F10 SF6 |
ClF ClF3 ClF5 |
|||||||||||
| KF | CaF2 | ScF3 |
TiF2 TiF3 TiF4 |
VF2 VF3 VF4 VF5 |
CrF2 СrF3 СrF4 СrF5 |
MnF2 MnF3 MnF4 |
FeF2 FeF3 |
CoF2 CoF3 |
NiF2 NiF4 |
CuF CuF2 |
ZnF2 | GaF3 |
GeF2 GeF4 |
AsF3 AsF5 |
SeF4 SeF6 |
BrF BrF3 BrF5 |
|
| RbF | SrF2 | YF3 |
ZrF2 ZrF3 ZrF4 |
NbF3 NbF4 NbF5 |
MoF3 MoF5 MoF6 |
TcF5 TcF6 |
RuF3 RuF5 RuF6 |
RhF3 RhF4 RhF5 RhF6 |
PdF2 PdF3 PdF4 |
AgF AgF2 |
CdF2 | InF3 |
SnF2 SnF4 |
SbF3 SbF5 |
TeF4 TeF6 |
IF IF3 IF5 IF7 |
|
| CsF | BaF2 | HfF4 | TaF5 |
WF4 WF5 WF6 |
ReF4 ReF5 ReF6 ReF7 |
OsF4 OsF5 OsF6 OsF7 OsF8 |
IrF3 IrF4 IrF5 IrF6 |
PtF2 PtF4 PtF5 PtF6 |
Au4F8 AuF3 AuF5 AuF5·F2 |
Hg2F2 HgF2 |
TlF TlF3 |
PbF2 PbF4 |
BiF3 BiF5 |
Po | At | ||
| Fr | RaF2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | ||
| ↓ | |||||||||||||||||
| LaF3 |
CeF3 CeF4 |
PrF3 PrF4 |
NdF3 | Pm |
SmF2 SmF3 |
EuF2 EuF3 |
GdF3 | Tb | DyF3 | HoF3 | Er | Tm |
YbF2 YbF3 |
LuF3 | |||
| AcF3 | ThF4 |
PaF4 PaF5 |
UF3 UF4 UF5 UF6 |
NpF3 NpF4 NpF5 NpF6 |
PuF3 PuF4 PuF6 |
Am | CmF3 | BkF4 | Cf | Es | Fm | Md | No | Lr | |||





![{\mathsf {BF_{3}+2HF\rightarrow H_{2}F^{+}+[BF_{4}]^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b7cf222171c2123fb0bb579add63b755167321d)
![{\mathsf {3NaF+AlF_{3}\rightarrow 3Na^{+}+[AlF_{6}]^{{3-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa0a65949ba8547f30c26a0664380fee08dd3321)
![{\mathsf {AlF_{3}+3BF_{3}\rightarrow Al^{{3+}}+3[BF_{4}]^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/303cbc2236584fcbc85671b5f5e42673e80c1af9)

![{\displaystyle {\mathsf {6HF+SiO_{2}\rightarrow H_{2}[SiF_{6}]+2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d2ea1bd5787e2ee429e823c776390c9b14504e6)



