Разработка лекарств
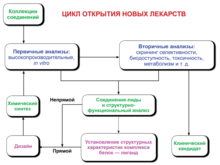
Разработка лекарств — это процесс вывода на рынок нового фармацевтического продукта.Он включает доклинические исследования in vivo и in vitro, подачу заявления на одобрение, например, через Минздрав России, чтобы начать клинические испытания на людях, и может включать этап получения регуляторного одобрения в виде заявления на новое лекарство для вывода лекарства на рынок. Весь процесс — от дизайна доклинического исследования в лаборатории до разработки клинических исследований, включая испытания I—III фазы, до одобрения вакцины или лекарства — обычно занимает более десяти лет.
Содержание
Разработка новых химических соединений
В целом процесс разработки лекарств можно разделить на доклинические и клинические этапы.
Доклинический этап
Новые химические соединения (NCE, также известные как новые молекулярные объекты или NME) — это соединения, которые появляются в процессе открытия лекарств. Они обладают многообещающей активностью в отношении определённой биологической мишени, важной для заболевания. Однако мало что известно о безопасности, токсичности, фармакокинетике и метаболизме этих новых химических соединений в организме человека. В функции разработки лекарств входит оценка всех этих параметров до проведения клинических испытаний на людях. Ещё одна важная задача разработки лекарств — рекомендовать дозу и график для первого применения в клинических испытаниях на человеке («первый в человеке» [FIH] или первая человеческая доза [FHD], ранее также известная как «первый в мужчине» [FIM]).
Кроме того, при разработке лекарств необходимо определить физико-химические свойства НМО: его химический состав, стабильность и растворимость. Производители должны оптимизировать процесс — от синтеза нескольких миллиграмм в лаборатории до производства партий вещества в несколько килограмм или тонн. Далее они проверяют продукт на пригодность к упаковке в виде капсул, таблеток, аэрозоля, внутримышечных инъекций, подкожных инъекций или внутривенных продуктов. В совокупности эти процессы известны в доклинической и клинической разработке как химия, производство и контроль(CMC).
Многие аспекты разработки лекарственных препаратов направлены на удовлетворение нормативных требований к заявлению на новое лекарство. Как правило, они представляют собой ряд исследований, направленных на определение основных токсических свойств нового соединения до его первого применения на людях. Согласно законодательству, необходимо провести оценку токсичности основных органов (воздействие на сердце и легкие, мозг, почки, печень и пищеварительную систему), а также воздействие на другие части тела, на которые может повлиять лекарство (например, на кожу, если новое лекарство будет применяться местно в виде мази/эмульсии/пластыря или вводиться подкожно). Такие предварительные испытания проводятся с использованием методов in vitro (например, с клеточными культурами), но во многих испытаниях для демонстрации сложного взаимодействия метаболизма и влияния лекарства на токсичность можно использовать только экспериментальных животных.
Информация, полученная в ходе доклинических испытаний, а также информация о CMC, подается в регулирующие органы (в США — в FDA, в России — в Минздрав) в виде заявления на исследумое новое лекарство. Если такое заявление одобряется, разработка переходит в клиническую фазу.
Клинический этап
Клинические испытания включают три или четыре этапа:
- Испытания фазы I, обычно на здоровых добровольцах, определяют безопасность и дозировку.
- Испытания фазы II используются для получения первоначальных данных об эффективности и дальнейшего изучения безопасности на небольшом количестве пациентов, страдающих заболеванием, на которое нацелено новое химическое соединение.
- Испытания фазы III это крупные, основополагающие испытания, направленные на определение безопасности и эффективности у достаточно большого числа пациентов с целевым заболеванием. Если безопасность и эффективность доказаны в достаточной степени, клинические испытания могут быть прекращены на этом этапе, новое химическое соединение переходит на стадию подачи заявления на новое лекарство (NDA).
- Испытания фазы IV — это испытания после утверждения, которые иногда являются условием, поставленным FDA,также называемые исследованиями по постмаркетинговому надзору.
Процесс установления характеристик лекарства не прекращается после того, как новое химическое соединение переходит к клиническим испытаниям на людях. В дополнение к испытаниям, необходимым для первого запуска новой вакцины или противовирусного средства в клинику, производители должны убедиться, что любые долгосрочные или хронические токсические эффекты четко определены, включая влияние на системы, которые ранее не отслеживались (фертильность, репродукция, иммунная система, и т. д.).
Если кандидат в вакцины или противовирусное соединение выходит из этих испытаний с приемлемым профилем токсичности и безопасности, и производитель может далее показать, что он оказывает желаемый эффект в клинических испытаниях, тогда портфель доказательств нового химического соединения может быть представлен для маркетингового утверждения в различных странах, где производитель планирует продавать его. В соединенных Штатах этот процесс называется «заявлением на новое лекарство» или NDА. В России Регистрационное досье собранное по формату ОТД подается в Минздрав России.
Большинство новых кандидатов в лекарственные препараты терпят неудачу в процессе разработки лекарств либо из-за неприемлемой токсичности, либо из-за того, что они просто не доказали эффективность в отношении целевого заболевания, как показали клинические испытания фазы II—III.Критические обзоры программ разработки лекарств показывают, что клинические испытания фазы II—III терпят неудачу в основном из-за неизвестных токсичных побочных эффектов (50 % неудач в испытаниях фазы II по кардиологии), а также из-за недостаточного финансирования, недостатков в дизайне испытаний или плохого проведения испытаний.
Проведение клинических исследований 1980-90-х годов показало, что только 21,5 % лекарственных препаратов, начавших испытания фазы I,в конечном итоге были одобрены для продажи. В 2006-15 годах коэффициент успешности получения одобрения от фазы I до успешных испытаний фазы III в среднем составлял менее 10 %, а для вакцин — 16 %. Высокий процент неудач, связанный с разработкой лекарственных препаратов, называют «коэффициентом отсева», что требует принятия решений на ранних стадиях разработки лекарственных препаратов, чтобы «убить» проекты на ранних стадиях, чтобы избежать крупных затрат на неэффективный продукт.
Стоимость
В одном из исследований 2010 года капитализированные и некапитализированные затраты на вывод на рынок одного нового продукта составили около 1,8 млрд долларов США и 870 млн долларов США соответственно. Средняя оценка затрат на испытания 2015-16 годов на разработку 10 противоопухолевых продуктов составила 648 млн долларов США. В 2017 году средняя стоимость базового исследования по всем клиническим показаниям составила 19 миллионов долларов.
Средняя стоимость (в долларах 2013 года) каждого этапа клинического исследования составляла 25 миллионов долларов США для исследования безопасности фазы I, 59 миллионов долларов США для рандомизированного контролируемого исследования эффективности фазы II и 255 миллионов долларов США для опорного исследования фазы III для демонстрации его эквивалентности или превосходства существующему одобренному лекарству,возможно, до 345 миллионов долларов. Средняя стоимость проведения в 2015—2016 годах опорного исследования фазы III лекарства-кандидата от инфекционных заболеваний составила 22 миллиона долларов.
Полная стоимость вывода на рынок нового лекарства (то есть нового химического соединения) — от открытия до клинических испытаний и утверждения — является сложной и противоречивой. В обзоре 106 кандидатов на лекарства, оцененных в ходе клинических испытаний, в 2016 году общие капитальные затраты производителя, имеющего лекарство, одобренное в ходе успешных испытаний фазы III, составили 2,6 миллиарда долларов (в долларах 2013 года), и сумма увеличивается на 8,5 % в год. В период с 2003 по 2013 год для компаний, которые одобрили 8-13 лекарств, стоимость одного лекарства может возрасти до 5,5 миллиардов долларов, в основном из-за международной географии маркетинга и текущих затрат на маркетинг. Испытания фазы IV для непрерывного наблюдения за безопасностью.
Альтернативы традиционной разработке лекарств имеют своей целью сотрудничество университетов, правительств фармацевтической промышленности и оптимизацию ресурсов. Примером совместной инициативы по разработке лекарств является COVID Moonshot, международный открытый научный проект, начатый в марте 2020 года с целью разработки незапатентованного перорального противовирусного препарата для лечения SARS-CoV-2.
Оценка
Природа проекта по разработке лекарств характеризуется высоким уровнем отсева, большими капитальными затратами и длительными сроками. Это делает оценку таких проектов и компаний сложной задачей. Не все методы оценки могут справиться с этими особенностями. Наиболее часто используемыми методами оценки являются чистая приведенная стоимость с поправкой на риск, деревья решений, реальные опционы или сопоставимые модели.
Наиболее важными факторами стоимости являются стоимость капитала или используемая ставка дисконтирования, атрибуты фазы, такие как продолжительность, показатели успеха и затраты, а также прогнозируемые продажи, включая стоимость товаров и расходы на маркетинг и продажи. Менее объективные аспекты, такие как качество управления или новизна технологии, должны быть отражены в оценке денежных потоков.
Показатель успешности
Кандидаты на новое лекарство для лечения какого-либо заболевания теоретически могут включать от 5 000 до 10 000 химических соединений. В среднем около 250 из них показывают достаточную перспективность для дальнейшей оценки с помощью лабораторных тестов, мышей и других подопытных животных. Как правило, около десяти из них подходят для испытаний на людях. Исследование, проведенное Центром Тафтса по изучению разработки лекарств в 1980-х и 1990-х годах, показало, что только 21,5 % лекарствов, начавших испытания фазы I, в конечном итоге были одобрены для продажи. В период с 2006 по 2015 год коэффициент успеха составил 9,6 %.Высокая частота неудач, связанных с фармацевтической разработкой, называется проблемой «уровня отсева». Тщательное принятие решений во время разработки лекарств необходимо, чтобы избежать дорогостоящих неудач. Во многих случаях продуманная программа и дизайн клинических испытаний могут предотвратить ложноотрицательные результаты. Хорошо спланированные исследования по определению дозы и сравнения как с плацебо, так и с золотым стандартом лечения играют важную роль в получении надежных данных.
ИТ-инициативы
Новые инициативы включают партнерство между правительственными организациями и промышленностью, например, Европейская инициатива по инновационным лекарствам. Управление по контролю за продуктами и лекарствами США создало «Инициативу критического пути» для повышения инновационности разработки лекарства также обозначение «Прорывная терапия» для ускорения разработки и нормативного рассмотрения лекарство-кандидатов, для которых предварительные клинические данные показывают, что лекарство-кандидат может существенно улучшить терапию серьёзного расстройства.
В марте 2020 года Министерство энергетики США , Национальный научный фонд , НАСА , промышленность и девять университетов объединили ресурсы чтобы получить доступ к суперкомпьютерам IBM в сочетании с облачными вычислительными ресурсами Hewlett Packard Enterprise, Amazon, Microsoft и Google для разработки лекарств. Консорциум высокопроизводительных вычислений COVID-19 также нацелен на прогнозирование распространения болезни, моделирование возможных вакцины и скрининг тысяч химических соединений для разработки вакцины или терапии COVID-19. В мае 2020 года было запущено партнерство OpenPandemics — COVID-19 между Scripps Research и IBM’s World Community Grid. Это партнерство представляет собой проект распределенных вычислений, который «будет автоматически запускать моделируемый эксперимент в фоновом режиме [на подключенных домашних компьютерах], который поможет предсказать эффективность конкретного химического соединения в качестве возможного лечения COVID-19».
См. также
- Совет по международным организациям медицинских наук
- Дизайн лекарств
- Репозиционирование лекарств
- Фармацевтическая инженерия
- Фармацевтическое производство
- Воспроизведенный препарат
- Международная конференция по гармонизации технических требований к регистрации лекарств для медицниского применения
- Список фармацевтических компаний
Ссылки
- Международный союз фундаментальной и клинической фармакологии