Гемагглютинин вируса гриппа
| Гемагглютинин | |
|---|---|
 | |
| Идентификаторы | |
| Символ | Гемагглютинин |
| Pfam | PF00509 |
| InterPro | IPR001364 |
| SCOP | 1hgd |
| SUPERFAMILY | 1hgd |
| OPM superfamily | 109 |
| OPM protein | 6hjq |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Стебель гемагглютинина вируса гриппа подтипа C | |
|---|---|
 Структура гликопротеина слияния гемагглютинина и эстеразы вируса гриппа С, полученная путём рентгеновской кристаллографии | |
| Идентификаторы | |
| Символ | Hema_stalk |
| Pfam | PF08720 |
| InterPro | IPR014831 |
| SCOP | 1flc |
| SUPERFAMILY | 1flc |
| OPM superfamily | 277 |
| OPM protein | 2jrd |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Гемагглютинин вируса гриппа (HA) — гомотримерный гликопротеин, обнаруживаемый на поверхности вируса гриппа и являющийся ключевым для его механизма заражения.
Гемагглютинин — белок слияния класса I, помимо функции присоединения к мембране клетки, в дальнейшем также непосредственно осуществляющий слияние мембран. Таким образом, гемагглютинин, с одной стороны, отвечает за присоединение вируса гриппа к молекуле сиаловой кислоты на мембране клетки-мишени — в частности, клеток верхних дыхательных путей или эритроцитов, с последующим эндоцитозом вируса. Далее, оказываясь в среде с низким pH (5.0-5.5), гемагглютинин вызывает слияние оболочки вируса с мембранной эндосомой.
Название «гемагглютинин» происходит от способности этого белка приводить к слипанию (агглютинации) красных кровяных клеток (эритроцитов) in vitro.
Содержание
Подтипы
Известно не менее 18 различных разновидностей гемагглютинина вируса гриппа типа A. Эти подтипы маркируются обозначениями от H1 до H18. Подтип H16 был идентифицирован в 2004 году в вирусах гриппа, обнаруженных у черноголовых чаек в Швеции и Норвегии; подтип H17 — в 2012 году у летучих мышей. Подтип H18 был обнаружен у летучей мыши из Перу в 2013 году. Первые три подтипа, H1, H2, and H3, встречаются в человеческих вирусах гриппа. По степени филогенетической схожести гемагглютинины гриппа делятся на две группы: в первую входят подтипы H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17 и H18, а во вторую — все остальные. Серотип вируса гриппа типа A определяется по подтипам находящихся на его поверхности гемагглютинина и нейраминидазы. Нейраминидаза (NA) имеет 11 известных подтипов; соответственно, серотип вируса обозначается как H1N1, H5N2 и т. д.
Высокопатогенный птичий грипп серотипа H5N1 оказался способным заражать людей, с невысокой частотой. Согласно сообщениям, у пациентов было найдено единственное изменение в аминокислотной последовательности гемагглютинина H5, которое «может значительно изменить специфичность к рецепторам у птичьих вирусов H5N1, тем самым давая им возможность присоединяться к рецепторам, оптимальным для вирусов гриппа человека». Эта находка, возможно, объясняет, как птичий вирус H5N1, который обычно не инфицирует людей, может мутировать и эффективно заражать клетки человека. Гемагглютинин вируса H5N1 был ассоциирован с высокой патогенностью этого птичьего штамма — вероятно, благодаря лёгкости его преобразования в активную форму посредством протеолиза.
Структура
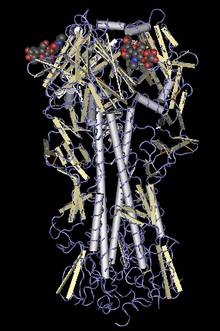
Гемагглютинин — гомотримерный мембранный гликопротеин. Он имеет форму цилиндра длиной около 13,5 нанометра. Тример гемагглютинина состоит из трёх идентичных мономеров, каждый из которых, в свою очередь, представляет собой одиночную полипептидную цепь HA0 с субъединицами HA1 и HA2, связанными двумя дисульфидными мостиками. Каждая из областей HA2 представляет собой структуру из альфа-спиралей, которая располагается поверх области HA1, представляющей собой небольшой округлый домен из нескольких α/β структур.
Тример гемагглютинина синтезируется в виде неактивного белка-предшественника HA0 во избежание нежелательного преждевременного слияния, и, чтобы стать активным, должен быть расщеплен при помощи протеаз клетки-хозяина. При нейтральных значениях pH, 23 остатка поблизости от N-конца субъединицы HA2 (также известные как пептид слияния, ответственный за соединение мембран вируса и клетки-хозяина) спрятаны в гидрофобном «кармане» между областями взаимодействия тримера HA2. C-конец субъединицы HA2, также известный как трансмембранный домен, проходит сквозь капсид вируса и фиксирует на нём белки.
- HA1
- Субъединица HA1 большей частью состоит из антипараллельных бета-листов.
- HA2
- Субъединица HA2 содержит три длинных альфа-спирали, по одной от каждого мономера. Каждая из этих спиралей присоединена при помощи длинного кольцевого региона, называемого «B-кольцом» (остатки 59-76).
Функции
Гемагглютинин играет две ключевые роли в проникновении вируса в клетку. Во-первых, он распознаёт клетки-мишени позвоночных, присоединяясь к рецепторам этих клеток, содержащим сиаловую кислоту. Во-вторых, после захвата вируса в эндосому клетки, он обеспечивает проникновение в клетку вирусного генома, обеспечивая слияние мембраны эндосомы с капсидом вируса.
В частности, его субъединица HA1 соединяется с моносахаридом — сиаловой кислотой, — присутствующим на поверхности его клеток-мишеней, тем самым прикрепляя вирион к поверхности клетки-хозяина. Было показано, что варианты HA17 и HA18 в качестве рецептора-цели используют не сиаловую кислоту, а молекулы главного комплекса гистосовместимости второго типа. Далее мембрана клетки-хозяина поглощает вирус путём эндоцитоза, и отслаивается, образуя новый мембраносвязанный отсек внутри клетки, называемый эндосомой. Затем клетка пытается уничтожить содержимое эндосомы, подкисляя её содержимое и превращая её в лизосому. Когда pH внутри эндосомы достигает уровня между 5.0 и 6.0, гемагглютинин претерпевает ряд конформационных изменений. Прежде всего, пептид слияния высвобождается из гидрофобного «кармана», а субъединица HА1 отсоединяется от субъединицы HА2. Затем субъединица HА2 претерпевает ряд значительных конформационных изменений, в результате которых мембраны вируса и эндосомы сближаются.
Пептид слияния, высвобожденный ранее пониженным уровнем рН, действует как молекулярный «абордажный крюк», внедряясь в мембрану эндосомы и закрепляясь в ней. Затем субъединица HA2 вновь изменяет конформацию (которая более стабильна при более низком рН), втягивая «абордажный крюк», тем самым приближая мембрану эндосомы вплотную к мембране самого вируса, в результате чего обе мембраны сливаются. Как результат, содержимое вирусной частицы в виде вирусной РНК высвобождается в цитоплазме клетки-хозяина, а затем транспортируется в ядро клетки-хозяина для репликации.
Гемагглютинин вируса как цель для лекарственных препаратов
Поскольку гемагглютинин играет ключевую роль в процессе проникновения вируса гриппа A в клетку, он является основной целью для нейтрализующих антител. Было показано, что такие антитела действуют по одному из нижеследующих механизмов, соответствующим каждой из функций гемагглютинина:
Антитела к головному участку
Некоторые антитела к гемагглютинину подавляют его прикрепление к клетке. Такие антитела прикрепляются вблизи «головки» гемагглютинина (выделена синим на рисунке выше) и физически не допускают его взаимодействия с рецепторами сиаловой кислоты на клетках-мишенях.
Стволовые антитела
Эта группа антител действует, препятствуя слиянию мембран вируса и эндосомы (только in vitro; эффективность таких антител in vivo считается результатом действия клеток иммунной системы, а также системы комлемента).
Область ствола или «стебля» субъединицы HA2 во многом высоко консервативна среди различных штаммов вирусов гриппа. Такая консервативность делает её привлекательной целью для нейтрализующих антител, которые смогут воздействовать на все подтипы вирусов гриппа, а также для разработки универсальной вакцины, которая позволит вырабатывать такие антитела естественным путём. Структурные изменения субъединицы HA2 от префузионной к постфузионной конформации приводят к слиянию вирусной мембраны с мембраной хозяина. Антитела, прикрепляющиеся к этой единице, могут помешать процессу слияния мембран, и тем самым заблокировать важную стадию жизненного цикла сразу многих серотипов вируса гриппа. По крайней мере одно рассмотренное антитело прикрепляется ближе к «голове» гемагглютинина, и считается, что оно действует, путем сшивания головок мономеров вместе, открытие которых считается первым шагом в процессе слияния мембран.
Примерами таких антител являются человеческие антитела F10, FI6, CR6261. Они распознают сайты в области «стебля» гемагглютинина (область, выделенная на рисунке оранжевым), находящиеся на значительном удалении от сайта связывания с рецептором.
В 2015 году исследователи разработали иммуноген, имитирующий ствол гемагглютинина, а конкретнее — его область, к которой присоединяется антитело CR9114. Эксперименты на модельных грызунах и приматах, которым вводился этот иммуноген, привели к появлению у них антител, способных соединятся с гемагглютининами многих подтипов гриппа, включая H5N1. В случае присутствия «головки» гемагглютинина иммунная система в общем случае не создаёт широко нейтрализующие антитела; вместо этого, она изготавливает антитела, которые «распознают» всего несколько подтипов вируса. Поскольку «головка» удерживает все три субъединицы гемагглютинина сложенными вместе, «только-стволовый» гемагглютинин нуждается в собственном способе удержания субъединиц. Одна команда учёных разработала самосборные наночастицы ствола гемагглютинина, используя белок, называемый ферритином, для удержания субъединиц гемагглютинина вместе. Другая команда использовала замену и добавление аминокислот для стабилизации «мини-гемагглютинина», у которого отсутствует собственная головка.
В экспериментах 2016 года был обнаружен ряд антител, произведённых иммунной системой человека, «настроенных» на присоединение к стволу. От ряда добровольцев были получены три класса похожих антител, что подтолкнуло исследователей к выводу, что создание универсальной вакцины, приводящей к надёжному созданию универсальных антител, всё-таки возможно.
Другие вещества
Существуют ингибиторы вируса гриппа, не являющиеся антителами, направленные на подавление функций гемагглютинина:
- Арбидол
- Малые Молекулы
- Природные соединения
- Белки и пептиды.