Биосинтез жирных кислот
Биосинтез жирных кислот — это биохимический путь синтеза жирных кислот клеткой из предшественников ацетил-КоА и НАДФН под действием ферментов называемых синтазы жирных кислот. Этот процесс происходит в цитоплазме клетки. Основная часть ацетил-КоА, которая превращается в жирные кислоты получается из углеводов в процессе гликолиза. В гликолитическом пути также образуется глицерин с которым могут соединяться три остатка жирных кислот (через сложноэфирные связи) образуя триглицериды (также известные, как «триацилглицеролы» — или просто «жир», названные так, чтобы отличить их от «жирных кислот»), конечного продукта процесса липогенеза. Если с глицерином соединяются только два остатка жирных кислот, а третья спиртовая группа фосфорилируется, например, фосфатидилхолином, образуются фосфолипиды. Фосфолипиды образуют липидные бислои, которые составляют основную часть клеточных мембран и мембран внутриклеточных органелл (например, клеточное ядро, митохондрии, эндоплазматический ретикулум, аппарат Гольджи и т. д.)
Содержание
- 1 Неразветвлённые жирные кислоты
- 2 Жирные кислоты с разветвлённой цепью
- 3 См. также
- 4 Комментарии
- 5 Примечания
- 6 Ссылки
Неразветвлённые жирные кислоты
Неразветвлённые жирные кислоты бывают двух типов: насыщенные и ненасыщенные.
Насыщенные неразветвлённые жирные кислоты
Подобно β-окислению, синтез неразветвлённых жирных кислот происходит при использовании шести повторяющихся реакций, показанных ниже, до тех пор, пока не образуется С16 пальмитиновая кислота. После семи циклов конденсации-восстановления образуется пальмитат, под действием тиоэстеразы он отщепляется от ацилпереносящего белка и покидает цикл.
Суммарную реакцию можно записать в виде:
- 8 Ацетил-КоА + 7 АТФ + 14 НАДФН + 14 H+ → пальмитат + 8 КоА + 7 АДФ + 7 Рн + 14 НАДФ+ + 6 Н2О
На представленных диаграммах показано, как происходит биосинтез жирных кислот в микроорганизмах и приведён перечень ферментов, обнаруженных в Escherichia coli. Эти реакции осуществляются синтазой жирных кислот II (FAS II), которая обычно представляет собой мультиферментный комплекс. FAS II найдена в прокариотах, растениях, паразитических организмах, а также в митохондриях позвоночных. Промежуточные продукты биосинтеза могут вовлекаться в другие реакции клеточного метаболизма, например, в синтезе липоевой кислоты. В отличие от FAS I, FAS II образует ненасыщенные разветвлённые жирные кислоты и гидроксикислоты.
У животных, а также у некоторых грибов, таких как дрожжи, те же реакции катализирует синтаза жирных кислот I (FAS I), большим белком из двух субъединиц, который обладает всеми ферментативными активностями, необходимыми для синтеза жирной кислоты. При синтезе жирных кислот происходит образование единственного продукта без высвобождения промежуточных продуктов. Промежуточные продукты ковалентно связаны тиоэфирной связью с ферментативным комплексом вплоть до финальной стадии. FAS I менее эффективен, чем FAS II; тем не менее, он позволяет образовывать больше молекул, включая жирные кислоты со «средней длиной цепи», обрывая удлинение цепи на ранней стадии синтеза.
После образования жирной кислоты — пальмитиновой (16:0) происходит ряд её модификаций, приводящих к десатурации и/или удлинению. Элонгация, начинающаяся со стеарата (18:0), осуществляется в основном в эндоплазматическом ретикулуме с помощью мембранно-связанных ферментов. Ферментативные реакции в процессе удлинения, в общем те же, что и при использовании FAS, но четыре основных последовательных этапов удлинения выполняются отдельными белками, которые могут быть физически связаны друг с другом.
| Стадия | Фермент | Реакция | Описание |
|---|---|---|---|
| (a) | Ацетил-КоА:ацилпереносящий белок-трансацилаза | Активация ацетил-КоА для реакции с малонил-ACP | |
| (b) | Малонил-КоА:ацилпереносящий белок-трансацетилаза |
|
Активация малонил-КоА для реакции с ацетил-ACP |
| (c) | 3-кетоацил-ацилпереносящий белок-синтаза | Реакция связанной с ACP ацильной группы с удлиняющей цепь малонил-ACP | |
| (d) | 3-кетоацил-ацилпереносящий белок-редуктаза | Восстанавливает кето-группу 3-го атома углерода до гидроксильной группы | |
| (e) | 3-гидроксиацил-ацилпереносящий белок-дегидратаза | Элиминирование воды | |
| (f) | Еноил-ацилпереносящий белок-редуктаза | Восстановление двойной связи между C2-C3 атомами. | |
| Обозначения: ACP — Ацилпереносящий белок, CoA — Кофермент А, NADP — Никотинамидадениндинуклеотидфосфат. | |||
Заметьте, что во время синтеза жирных кислот восстанавливающим агентом является НАДФН, тогда как НАД является окислителем в реакциях бета-окисления (расщеплении жирных кислот до ацетил-КоА). Это различие иллюстрирует общий принцип, согласно которому НАДФН расходуется во время реакций биосинтеза, тогда как НАДН генерируется в реакциях окисления с выделением энергии.. Таким же образом, НАДФН необходим для синтеза холестерина из ацетил-КоА; в то время как НАДН образуется во время окисления глюкозы.) Основных источников НАДФН два. Первый, когда малат окислительно декарбоксилируется «НАДФ+-зависимым малик-ферментом» с образованием пирувата, CO2 и НАДФН. НАДФН также образуется в пентозофосфатном пути который преобразует глюкозу в рибозу, которая может использоваться в синтезе нуклеотидов и нуклеиновых кислот, или может катаболизироваться до пирувата.
Превращение углеводов в жирные кислоты
У человека жирные кислоты образуются из углеводов преимущественно в печени и жировой ткани, а также в молочных железах во время лактации.
Пируват, образующийся при гликолизе, является важным промежуточным соединением в превращении углеводов в жирные кислоты и холестерин. Начальная стадия превращения пирувата в ацетил-КоА идёт в митохондриях. Однако, этот ацетил-КоА необходимо транспортировать в цитозоль, где осуществляются реакции синтеза жирных кислот и холестерина. Это не может произойти напрямую, так как внутренняя мембрана митохондрий непроницаема для ацетил-КоА. Для транспортировки в цитозоль ацетил-КоА реагирует с оксалоацетатом с образованием цитрата. Цитрат полученный таким образом в цикле Кребса покидает цикл и транспортируется мембранным переносчиком через мембрану митохондрий в цитозоль. Там он расщепляется АТФ-цитратлиазой на ацетил-КоА и оксалоацетат. Оксалоацетат может быть использован для глюконеогенеза (в печени), или он может быть возвращён в митохондрии в виде малата. Цитозольный ацетил-КоА карбоксилируется ацетил-СоА-карбоксилазой до малонил-КоА, это первая решающая стадия в биосинтезе жирных кислот.
Животные не способны обратно синтезировать углеводы из жирных кислот
Основным источником энергии, и запасным веществом у животных служит жир. Жир у молодого взрослого человека составляет в среднем около 15-20 кг, но это сильно зависит от возраста. Пола и индивидуальных особенностей. В противоположность этому, в человеческом теле хранится только лишь около 400 г гликогена, из которых 300 г хранятся внутри скелетных мышц и недоступны для организма в целом. Остальные примерно 100 г гликогена, хранящегося в печени, истощаются в течение одного дня голодания. После этого глюкоза, поступившая в кровь из печени для общего использования тканями организма, должна быть синтезирована из глюкогенных аминокислот и некоторых других глюкогенных субстратов, в число которых не входят жирные кислоты.
Расщепление жирных кислот до ацетил-КоА при бета-окислении происходит внутри митохондрий, тогда как их синтез из ацетил-КоА идёт в цитозоле. Эти два пути отличаются не только по месту их локализации, но и по протекающим реакциям и используемых субстратах и коферментах. Эти два пути взаимно ингибируют друг друга, предотвращая попадание ацетил-КоА, образуемого в результате бета-окисления, в путь синтеза посредством реакции осуществляемой ацетил-СоА-карбоксилазой. Он также не может быть преобразован в пируват, так как реакция декарбоксилирования пирувата необратима. Вместо этого он конденсируется с оксалоацетатом с образованием цитрата, для входа в цикл трикарбоновых кислот. При каждом обороте цикла, два атома углерода покидают цикл в виде CO2 в реакциях декарбоксилирования катализируемых изоцитрат-дегидрогеназой и альфа-кетоглутарат-дегидрогеназой. Таким образом каждый оборот цикла трикарбоновых кислот окисляет единицу ацетил-КоА, одновременно регенерируя молекулу оксалоацетата, с которой ацетил-КоА первоначально объединился с образованием лимонной кислоты. Реакции декарбоксилирования происходят до того, как в цикле образуется малат. Малат — единственное вещество, которое способно покинуть митохондрию, для того чтобы попасть в путь глюконеогенеза с образованием глюкозы или гликогена в печени или любой другой ткани. Следовательно, не может быть преобразования жирных кислот в глюкозу.
Только растения обладают ферментами для преобразования ацетил-КоА в оксалоацетат из которого может быть образован малат, который в конечном итоге превратиться в глюкозу.
Регуляция
Ацетил-КоА превращается в малонил-КоА под действием ацетил-СоА-карбоксилазы, с этого момента малонил-КоА предназначен для включения в путь синтеза жирных кислот. Ацетил-СоА-карбоксилаза является точкой регуляции синтеза насыщенных жирных кислот с неразветвлённой цепью и подвергается как фосфорилированию, так и аллостерической регуляции. Фосфорилирование происходит в основном у млекопитающих, тогда как аллостерическая регуляция наблюдается у остальных организмов. Аллостерический контроль осуществляется путём ингибирования по принципу обратной связи пальмитоил-КоА и активации цитратом. При высоком уровне пальмитоил-КоА, конечного продукта синтеза насыщенных жирных кислот, он аллостерически инактивирует ацетил-КоА-карбоксилазу, что предотвращает накопление жирных кислот в клетках. Цитрат действует как активатор ацетил-КоА-карбоксилазы при высоких концентрациях, потому что высокие уровни указывают на то, что ацетил-КоА достаточно для включения в Цикл трикарбоновых кислот и запасания энергии
Высокий уровень инсулина в плазме крови (например, после еды) вызывает дефосфорилирование ацетил-КоА-карбоксилазы, тем самым способствуя образованию малонил-КоА из ацетил-КоА и, следовательно превращению углеводов в жирные кислоты, а адреналин и глюкагон (выделяемые в кровь во время голодания и физических упражнений) вызывают фосфорилирование этого фермента, ингибируя липогенез и стимулируя бета-окисление жирных кислот.
Ненасыщенные жирные кислоты с неразветвлённой цепью
Анаэробная десатурация
Многие бактерии используют анаэробный путь для синтеза ненасыщенных жирных кислот. В реакциях этого пути не используется кислород и используются ферменты, вставляющие двойную связь перед удлинением углеродного скелета жирной кислоты, в остальном используя нормальный механизм синтеза жирных кислот. В Escherichia coli, этот путь хорошо изучен.
- FabA представляет собой β-гидроксидеканоил-ACP-дегидратазу — она специфично действует на промежуточное 10-углеродного соединение β-гидроксидеканоил-ACP, образуемое при синтезе насыщенных жирных кислот.
- FabA катализирует дегидратацию β-гидроксидеканоил-ACP, с образованием воды и вставки двойной связи между C7 и C8 атомами углерода, считая от метильного конца. Это вызывает образование промежуточного транс-2-деценоила-ACP.
- Далее, связанный с активном центром фермента транс-2-деценоил-ACP может быть вовлечён в реакции обычного пути синтеза насыщенных жирных кислот под действием FabB, где двойная связь будет восстановлена и продуктом будет насыщенный пальмитоил-АСР, либо подвергнуться действию FabA, под действием которого он изомеризуется в цис-3-деценоил-ACP. Этот цис-изомер не распознаётся специфичной редуктазой, но наращивается синтазой.
- FabB представляет собой β-кетоацил-ACP-синтазу, которая удлиняет и направляет промежуточные соединения в главный путь синтеза жирных кислот. Когда FabB действует на цис-3-деценоил, конечными продуктами после удлинения цепи будут ненасыщенные жирные кислоты.
- Синтезируются две основные ненасыщенные жирные кислоты: пальмитолеил-ACP (16:1ω7) and цис-вакценоил-ACP (18:1ω7).
Большинство бактерий, проводящие реакции анаэробной десатурации, содержат гомологи FabA и FabB. Клостридии служат основным исключением. У них есть новый фермент, катализирующий образование двойной цис-связи, который ещё предстоит идентифицировать.
Регуляция
Этот путь подвержен транскрипционной регуляции с помощью FadR и FabR. FadR является более изученным белком, которому приписывают сразу две функции. Он действует как активатор транскрипции fabA и fabB и как репрессор регулонаа отвечающего за β-окисление. Напротив, FabR действует как репрессор транскрипции fabA и fabB.
Аэробная десатурация
Аэробная десатурация — наиболее распространённый путь синтеза ненасыщенных жирных кислот. Он используется всеми эукариотами и некоторыми прокариотами. В реакциях синтеза ненасыщенных жирных кислот из полноразмерных насыщенных жирных кислот этого пути используются десатуразы. Все десатуразы требуют кислорода и, в конечном итоге, потребляют НАДН, хотя десатурация является окислительным процессом. Десатуразы специфично вносят двойную связь в определённое место в субстрате. У Bacillus subtilis, десатураза, Δ5-Des, специфична для внесения цис-двойной связи в положение Δ5. Saccharomyces cerevisiae содержит одну десатуразу, Ole1p, которая вводит цис-двойную связь в Δ9..
Регуляция
У B. subtilis, этот путь регулируется двухкомпонентной системой: связанная с мембраной киназой DesK и транскрипционным регулятором DesR отвечающими за экспрессию гена des. Экспрессия зависит от температуры. Когда температура падает, этот ген активируется. Ненасыщенные жирные кислоты увеличивают текучесть мембраны и стабилизируют её при более низких температурах. DesK это сенсорный белок, автофосфорилирующийся при понижении температуры. DesK-P затем переносит фосфорильную группу на DesR. Две молекулы DesR-P белка димеризуются и связываются с ДНК промоторов des гена и способствуют связыванию РНК-полимеразы для старта транскрипции.
Pseudomonas aeruginosa
Как правило, анаэробный и аэробный синтез ненасыщенных жирных кислот не встречаются в одновременно в одном организме, однако Pseudomonas aeruginosa и Vibrio ABE-1 служат исключениями из правил. Хотя P. aeruginosa в основном использует реакции анаэробной десатурации, она также имеет два аэробных пути. В одном пути используется Δ9-десатураза (DesA) которая катализирует образование двойной связи в мембранных липидах. Другой путь использует два белка, DesC и DesB, вместе они действуют как Δ9-десатураза, которая вставляет двойную связь в остаток насыщенной кислоты в молекуле ацил-КоА. Этот второй путь регулируется репрессорным белком DesT. DesT также подавляет экспрессию fabAB при анаэробной десатурации в присутствии экзогенных ненасыщенных жирных кислот. Такая функция обеспечивает координацию экспрессии двух путей в клетке. У млекопитающих аэробная десатурация катализируется комплексом из трёх мембранносвязанных ферментов (НАДН-цитохром b5-редуктазой, цитохромом b5, и десатуразой). Эти ферменты позволяют молекулярному кислороду, O2, взаимодействовать с остатком насыщенной жирной кислоты, в молекуле ацил-КоА, с образованием двойной связи и двух молекул воды, H2O. Два электрона поставляет НАДН + H+ и два беруться из одинарной связи цепи жирной кислоты. Однако десатуразы млекопитающих неспособны создавать двойные связи у атомов углерода за пределами С9 в цепи жирных кислот .) Следовательно млекопитающие не могут синтезировать ни линолеат или линоленат (которая имеет двойную связь в позиции C-12 (= Δ12), или C-12 и C-15 (= Δ12 и Δ15), соответственно, а также в положении Δ9), ни полиненасыщенную, 20-углеродную арахидоновую кислоту, производную линолеата. Все они называются незаменимыми жирными кислотами, что означает, что они необходимы организму, но могут поступать только с пищей. Арахидоновая кислота является предшественником простагландинов, которые выполняют широкий спектр функций в качестве локальных гормонов.
Жирные кислоты с нечётной цепью
Жирные кислоты с нечётной цепью (OCFAs) это те жирные кислоты, которые содержат нечётное количество атомов углерода в составе своей молекулы. Наиболее распространёнными OCFAs являются насыщенные производные C15 и C17, соответственно пентадекановая кислота и маргариновая кислота. Синтез жирных кислот с чётной цепью осуществляется путём сборки из двухуглеродных единиц ацетил-КоА. При использовании в качестве праймера для биосинтеза пропионил-КоА вместо ацетил-КоА, получаются длинноцепочечные жирные кислоты с нечётным количеством атомов углерода.
Жирные кислоты с разветвлённой цепью
Жирные кислоты с разветвлённой цепью обычно являются насыщенными и подразделяются на два различных семейства: на изо- и на антеизо-семейство. Было обнаружено, что Actinomycetales обладают уникальными механизмами синтеза жирных кислот с разветвлённой цепью, в том числе те которые образуют миколовые кислоты.
Системы синтеза жирных кислот с разветвлённой цепью
Система синтеза жирных кислот с разветвлённой цепью с использованием α-кетокислоты как затравки
Использование α-кетокислоты, как затравки служит отличием от путей синтеза разветвлённых жирных кислот, где в качестве затравки синтетаза использует эфиры Ацетил-КоА с короткой цепью. Затравки α-кетокислот являются производными при переаминировании и декарбоксилировании валина, лейцина, изолейцина до 2-метилпропанил-КоА, 3-метилбутирил-КоА, и 2-метилбутирил-КоА, соответственно. 2-метилпропанил-КоА праймер, образующийся из валина при удлинении дают начало жирным кислотам изо-ряда с чётным количеством атомов углерода, таким как 14-метил-пентадекановая (изопальмитиновая) кислота. 3-метилбутирил-КоА праймер из лейцина может использоваться для образования изо-кислот с нечётным числом атомов углерода, таких как 13-метил-тетрадекановая кислота. При удлинении затравки 2-метилбутирил-КоА из изолейцина получаются антеизо-ряда жирных кислот с нечётным числом атомов углерода, таких как 12-метил-тетрадекановая кислота. Декарбоксилирование предшественников праймеров происходит при помощи фермента декарбоксилизы α-кетокислот с разветвлённой цепью (BCKA). Удлинение скелета жирной кислоты в Escherichia coli происходит также, как при синтезе жирных кислот с прямой цепью, когда малонил-КоА используется в качестве первоначального звена биосинтеза. Основными конечными продуктами являются жирные кислоты с разветвлённой цепью, состоящие из 12-17 атомов углерода, и их состав является постоянным и характерным для многих видов бактерий.
Декарбоксилиза α-кетокислот с разветвлённой цепью (BCKA) и её субстратная специфичность по отношению к α-кетокислотам
Фермент BCKA-декарбоксилаза состоит из двух субъединиц образуя тетрамер (А2B2) и является необходимой для синтеза жирных кислот с разветвлённой цепью. Она отвечает за декарбоксилирование α-кетокислот, образующихся при дезаминировании валина, лейцина и изолейцина и производит затравочные молекулы, используемые для синтеза жирных кислот с разветвлённой цепью. Активность этого фермента намного выше по отношению к субстратам α-кетокислот с разветвлённой цепью, чем с прямой, а у видов Bacillus наибольшая специфичность достигается по отношению производного изолейцина α-кето-β-метилвалериановой кислоте, за которой следует α-кетоизокапроат и α-кетоизовалериат. Высокое сродство фермента к α-кетокислотамс разветвлённой цепью позволяет ему функционировать в качестве поставщиков затравочных молекул для синтетезы жирных кислот с разветвлённой цепью.
| Субстрат | Активность BCKA декарбоксилазы | Выделяемый CO2 (нмоль/мин мг) | Km (μM) | Vmax (нмоль/мин мг) |
|---|---|---|---|---|
| L-α-кето-β-метил-валериат | 100 % | 19.7 | <1 | 17.8 |
| α-кетоизовалериат | 63 % | 12.4 | <1 | 13.3 |
| α-кетоизокапроат | 38 % | 7.4 | <1 | 5.6 |
| Пируват | 25 % | 4.9 | 51.1 | 15.2 |
Факторы, влияющие на длину цепи и её разветвлённость
Праймеры α-кетокислот используются для биосинтеза жирных кислот с разветвлённой цепью, которые, как правило, имеют от 12 до 17 атомов углерода. Соотношение кислот с разветвлённой цепью постоянно и специфично для конкретных видов бактерий, но они могут измениться при изменении в концентрации малонил-КоА, температуры или наличия факторов термостабильности (HSF). Все эти факторы могут влиять на длину цепи, и было показано, что HSF изменяют специфичность BCKA-декарбоксилазы по отношению к определённым α-кетокислотам, таким образом изменяя соотношение продуцируемых жирных кислот с разветвлённой цепью. Было показано, что увеличение концентрации малонил-КоА приводит к увеличению продукции C17 жирных кислот, до тех пор, пока не будет достигнута оптимальная концентрация (≈20μM) малонил-КоА. Понижение температуры также немного сдвигает соотношение жирных кислот в сторону С17 кислот в видах Bacillus.
Система синтеза жирных кислот с разветвлённой цепью с использованием эфиров KoA
Эта система функционирует аналогично системе синтеза жирных кислот с разветвлённой цепью с использованием в качестве затравок альфа-кетокислот, однако вместо них в ней используются, в качестве затравки, эфиры карбоновых кислот с короткой цепью с КоА. Этот путь используется бактериями не способными использовать альфа-кетокислоты. Типичные праймерами служат изовалериат, изобутират и 2-метил-бутират. Как правило, кислоты, необходимые для этих затравок поступают из окружающей среды; такое часто встречается у бактерий обитающих в рубце.
Суммарная реакция:
- Изобутирил-КоА + 6 малонил-CoA +12 НАДФН + 12H+ → Изопальмитиновая кислота + 6 CO2 + 12 НАДФ + 5 H2O + 7 КоА
Различие между синтазами жирных кислот с линейной и разветвлённой цепями заключается в субстратной специфичности фермента, который катализирует реакцию ацил-CoA с ацил-ACP.
Омега-алициклические жирные кислоты
Омега-алициклические жирные кислоты обычно содержат омега-концевую пропильную или бутирильную циклическую группу и являются одними из основных мембранных жирных кислот, обнаруживаемых у нескольких видов бактерий. Синтетаза жирных кислот, используемая для производства омега-алициклических жирных кислот, также используется для получения мембранных жирных кислот с разветвлённой цепью. У бактерий с мембранами, состоящими в основном из омега-алициклических жирных кислот, количество сложных эфиров циклических карбоновых кислот и КоА намного больше, чем праймеров с разветвлённой цепью. Синтез циклических праймеров не совсем понятен, но было высказано предположение, что механизм включает преобразование сахаров в шикимовую кислоту, которая затем превращается в эфиры циклогексилкарбоновой кислоты c КоА, которые служат праймерами для синтеза омега-алициклических жирных кислот.
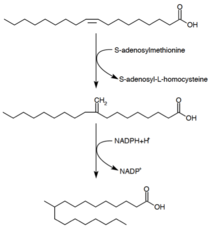
Синтез туберкулостеариновой кислоты
Туберкулостеариновая кислота (10-метилстеариновая кислота) является насыщенной жирной кислотой, которая, как известно продуцируется видами Mycobacterium spp. и двумя видами Streptomyces. Она образуется из предшественника, олеиновой кислоты (мононенасыщенной жирной кислоты. После этерификации олеиновой кислоты до фосфолипида, S-аденозил-метионин служит донором метильной группы для двойной связи олеиновой кислоты. Эта реакция метилирования образует промежуточное соединение 10-метилен-октадеканоал. Последовательное восстановление его НАДФН в качестве кофермента приводит к 10-метилстеариновой кислоте