ETF-дегидрогеназа
| ETF-дегидрогеназа | |
|---|---|
 Ленточная диаграмма ETF-дегидрогеназы. Каждый функциональный домен покрашен своим цветом. Голубой полоской обозначена внутренняя мембрана митохондрии. | |
| Обозначения | |
| Символы | ETFD; ETF-QO |
| Entrez Gene | 2110 |
| HGNC | 3483 |
| OMIM | 231675 |
| PDB | 2GMH |
| RefSeq | NM_004453 |
| UniProt | Q16134 |
| Другие данные | |
| Шифр КФ | 1.5.5.1 |
| Локус | 4-я хр., 4q 4q32.1 |
|
| |
ETF-дегидрогеназа или (электронпереносящий флавопротеин)-дегидрогеназа (сокр. от англ. electron transfer flavoprotein-ubiquinone dehydrogenase) — фермент, который переносит электроны с электронпереносящего флавопротеина (ETF), растворённого в матриксе митохондрий, на мембранный переносчик электронов — убихинон. Этот фермент есть как у прокариот, так и эукариот. У этого энзима есть две простетические группы: флавин и железосерный кластер. Нехватка ETF-дегидрогеназы у человека вызывает наследственное заболевание глутаровая ацидемия второго типа. Кроме того, этот фермент — третья точка поступления электронов в ЭТЦ.
Содержание
Функция
У млекопитающих этот фермент важен в β-окислении жирных кислот, катаболизме аминокислот и холина. Он связывает β-окислении жирных кислот и прочие процессы с окислительным фосфорилирование. Множество ацетил-СоА-дегидрогеназ осуществляют окисление разных субстратов (например жирных кислот), перенося электроны на электронперносящий флавопротеин (ETF). ETF-дегидрогеназа в свою очередь окисляет этот белок и переносит электроны на растворённый во внутренней мембране митохондрий убихинон, восстанавливая его до убихинола, который затем поступает в дыхательную цепь переноса электронов.
Ацил-КоА → Ацил-КоА-дегидрогеназа → ETF → ETF-дегидрогеназа → Q → Комплекс III
У растений ETF-Q-дегидрогеназа важна для выживания во время стресса и длительного периода темноты.
Реакция
ETF-дегидрогеназа катализирует следующую реакцию:
- ETFвосстановленный + Q → ETFокисленный + QH2.
Механизм
Точный механизм восстановления убихинона неизвестен, но существуют две гипотезы. Согласно первой гипотезе электроны по одному передаются с ETF на низкопотенциальный ФАД. В результате в восстановленном состоянии один электрон остаётся на ФАД, а другой на железном центре. После этого восстанавливается убихинон, с переходом через стадию семихинона. Согласно второй гипотезе ETF передаёт электроны на железосерный центр, после чего происходит быстрый переброс между двумя центром и ФАД. После наступления равновесия, всё остальное происходит по вышеописанной схеме.
Структура фермента
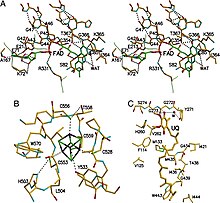
ETF-дегидрогеназа состоит из одного структурного домена и трёх близкорасположенных функциональных доменов: ФАД-связыввающий домен, 4Fe4S-связывающий домен и убихинон-связывающий домен. ФАД глубоко погружён в белковую часть своего домена. Множество водородных связей и положительный конец диполя из α-спирали оказывают влияние на редокс-потенциал ФАД и, возможно, стабилизируют семихинон-радикал. Железосерный кластер 4Fe-4S также стабилизирован обширными водородными связями вокруг самого кластера и его цистеинов. Связывание убихинона происходит в глубоком гидрофобном кармане, который у этого фермента отличается от других убихинон-связывающих белков, таких как сукцинатдегидрогеназа. В отличие от других убихинон-связывающих ферментов, этот фермент прикрепляется к поверхности мембраны и не пересекает липидный бислой.
В медицине
Недостаток ETF-дегидрогеназы приводит к развитию глутаровой ацидимии второго типа (также известной как множественная ацил-КоА-дегидрогеназная недостаточность), которая характеризуется нарушением распада жирных кислот и аминокислот. Болезнь может вызывать ацидоз или гипогликимию. К другим симптомам относится общая слабость, увеличенная печень, сердечная недостаточность и пониженное содержание левокарнитина. В более тяжёлых случаях могут наблюдаться врожденные пороки и полный метаболитический кризис. С точки зрения генетики — это аутосомное рецессивное наследственное заболевание. По этой причине оно встречается довольно редко. У большинства пациентов выявлена однонуклеотидная замена в месте взаимодействия ФАД и убихинона Более лёгкие формы этого расстройства поддаются лечению рибофлавиновой терапией, однако, из-за разнообразия мутаций, приводящих к развитию заболевания, симптоматика и соответствующее лечение могут сильно разниться.
См. также
Внешние ссылки
- ENZYME entry on EC 1.5.5.1 Архивная копия от 16 мая 2011 на Wayback Machine
- BRENDA entry on EC 1.5.5.1
- OMIM 231680