
Оксид мышьяка(III)
| Оксид мышьяка(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Arsenic trioxide |
| Традиционные названия | белый мышьяк |
| Хим. формула | As2O3 |
| Рац. формула | As2O3 |
| Физические свойства | |
| Молярная масса | 197.841 г/моль |
| Плотность | 3.74 г/см³ |
| Классификация | |
| Рег. номер CAS | 1327-53-3 |
| PubChem | 261004 |
| Рег. номер EINECS | 215-481-4 |
| SMILES | |
| InChI | |
| RTECS | CG3325000 |
| ChEBI | 30621 |
| ChemSpider | 229103 |
| Безопасность | |
| Предельная концентрация | 0.01 мг/м³ |
| ЛД50 | 14,6 мг/кг (крысы, орально) |
| Токсичность | чрезвычайно токсичен |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид мышьяка(III) — неорганическое соединение с химической формулой As2O3, являющееся ценным химическим сырьём для получения других производных мышьяка, в том числе мышьяксодержащих органических соединений. Валовой объём производства в мире — 50 000 тонн в год. Однако безопасность его применения во многих областях подвергается сомнению из-за высокой токсичности.
Содержание
Получение и свойства
Оксид мышьяка(III) может быть получен многими способами, включая окисление (горение) мышьяка и его производных на воздухе. Показательна реакция разложения аурипигмента, сульфида мышьяка:
Большая часть, однако, является побочным продуктом других производств — золотодобычи и получения меди, где он выделяется при прокаливании на воздухе, что приводило к многочисленным массовым отравлениям. В настоящее время интенсивная добыча мышьяковых руд ведётся только в Китае.
Оксид мышьяка(III) является амфотерным оксидом, его раствор обладает слабокислой реакцией. В щелочных растворах образует арсениты, в концентрированной соляной кислоте даёт хлорид мышьяка(III).

Некоторые окислители — озон, пероксид водорода, азотная кислота — способны превратить его в оксид мышьяка(V) As2O5.

Структура
В жидком и газообразном (до 800 °C) состояниях имеет формулу As4O6 (в форме димера) и изоструктурен P4O6). При нагреве свыше 800 °C As4O6 распадается на молекулы As2O3, схожий по строению с N2O3. В твёрдом состоянии сосуществуют три полиморфных формы: кубический молекулярный As4O6 и две полимерные формы. Полимеры, образующие при остывании монокристаллы, напоминают пирамидальную структуру AsO3 с общими атомами кислорода.
 |
 |
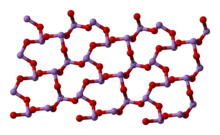
|
(cubic) |
(monoclinic) |
(monoclinic) |
Использование
Оксид мышьяка(III) используется для изготовления цветного стекла, также применяется в лесохимии и электротехнике полупроводников, получения чистого мышьяка и его соединений, таких как какодилат натрия и арсенид натрия.
В соединении с ацетатом меди(II) триоксид мышьяка образует красящее вещество — парижскую зелень, который более не применяется из-за высокой токсичности.
Применение в медицине
Используется с древнейших времён в китайской медицине, а также (с XIX века) в гомеопатии. В конвенциональной медицине триоксид мышьяка используется для лечения злокачественных опухолей, таких как лейкемия, однако ввиду высоких рисков его применения предпочтение отдаётся другим препаратам.
Также триоксид мышьяка успешно лечит аутоиммунные заболевания, взаимодействует с ферментом тиоредоксиновая редуктаза.
Обнаружение в природе
As2O3 содержится в арсенолите и клаудетите.
Токсикология
Оксид мышьяка (III) ядовит. Его токсичность стала легендарной и широко описана в литературе.
В Австрии жили «мышьякоеды», получавшие дозы во много раз больше смертельной без особого вреда для здоровья. Считается, что мышьяк повышает работоспособность, особенно при работе на больших высотах.
ПДК для неорганических соединений мышьяка, включая As2O3, составляет 0.01 мг/м³.
Полулетальная доза — 19,1 мг/кг.
Ссылки
- На английском языке
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity Архивная копия от 8 мая 2020 на Wayback Machine
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378 Архивная копия от 30 сентября 2007 на Wayback Machine
- NIOSH Pocket Guide to Chemical Hazards Архивная копия от 11 мая 2017 на Wayback Machine
- NTP Report on Carcinogens — Inorganic Arsenic Compounds Архивная копия от 11 ноября 2005 на Wayback Machine
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine Архивная копия от 12 апреля 2006 на Wayback Machine.
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds

