
Оксалат аммония
Подписчиков: 0, рейтинг: 0
| Оксалат аммония | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксалат аммония |
| Традиционные названия | Щавелевокислый аммоний |
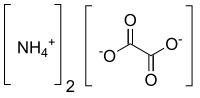
| Хим. формула | (NH4)2C2O4 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 124,10 г/моль |
| Плотность | гидр. 1,50 г/см³ |
| Термические свойства | |
| Энтальпия | |
| • образования | -1424 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 2,30; 10,350 г/100 мл |
| • в этаноле | не растворяется |
| Классификация | |
| Рег. номер CAS | 1113-38-8 |
| PubChem | 14213 |
| Рег. номер EINECS | 214-202-3 |
| SMILES | |
| InChI | |
| ChEBI | 91241 |
| ChemSpider | 13577 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксалат аммония — химическое соединение, соль аммония и щавелевой кислоты с формулой (NH4)2C2O4, бесцветные кристаллы, растворяется в воде, образует кристаллогидрат.
Получение
- Действие раствора аммиака на раствор щавелевой кислоты:
Физические свойства
Оксалат аммония образует бесцветные кристаллы, растворяется в воде, не растворяется в этаноле.
Образует кристаллогидрат состава (NH4)2C2O4•H2O.
Химические свойства
- Безводную соль получают медленной сушкой кристаллогидрата при незначительном нагревании.
Применение
- В аналитической химии.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
