Морфеин
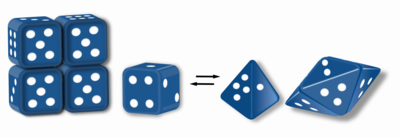
Морфеины - это белки, которые могут образовывать два или более различных гомо-олигомера (формы морфеина), но должны распадаться и изменять форму для преобразования между формами. Альтернативная форма может собираться в другой олигомер. Форма субъединицы определяет, какой олигомер образуется. Каждый олигомер имеет конечное число субъединиц (стехиометрия). Морфеины могут взаимодействовать между формами в физиологических условиях и могут существовать в виде равновесия различных олигомеров. Эти олигомеры физиологически релевантны и не являются неправильно свернутым белком; это отличает морфеины от прионов и амилоида. Различные олигомеры обладают различной функциональностью. Взаимопревращение морфеиновых форм может быть структурной основой аллостерической регуляции.Мутация, которая изменяет нормальное равновесие форм морфеина, может служить основой для конформационного заболевания. Особенности морфеинов могут быть использованы для открытия лекарств. Изображение кубика (рис.1) представляет собой равновесие морфеина, содержащее две различные мономерные формы, которые диктуют сборку тетрамера или пентамера. Единственным белком, который, как установлено, функционирует как морфеин, является порфобилиногенсинтаза, хотя в литературе есть предположения, что другие белки могут функционировать как морфеины (для получения дополнительной информации см. "Таблицу предполагаемых морфеинов" ниже).
Конформационные различия между субъединицами разных олигомеров и связанные функциональные различия морфеина служат отправной точкой для открытия лекарств. Функция белка зависит от олигомерной формы; следовательно, функцию белка можно регулировать, сдвигая равновесие форм. Низкомолекулярное соединение может сдвигать равновесие, блокируя или способствуя образованию одного из олигомеров. Равновесие можно сдвинуть с помощью небольшой молекулы, которая имеет преимущественное сродство связывания только с одной из альтернативных форм морфеина. Задокументирован ингибитор порфобилиногенсинтазы с таким механизмом действия.
Содержание
Значение для аллостерической регуляции
Морфеиновая модель аллостерической регуляции имеет сходства и отличия от других моделей. Согласованная модель (модель Monod, Wyman and Changeux (MWC)) аллостерической регуляции требует, чтобы все субъединицы находились в одной и той же конформации или состоянии внутри олигомера, такого как модель морфеина. Однако ни эта модель, ни последовательная модель (модель Кошланда, Немети и Филмера) не учитывают, что белок может диссоциировать, чтобы взаимно преобразовываться между олигомерами.
Значение для обучения взаимосвязям "структура-функция" белка
Обычно считается, что аминокислотная последовательность будет иметь только одну физиологически релевантную (нативную) четвертичную структуру; морфеины бросают вызов этой концепции. Модель морфеина не требует серьезных изменений в основной белковой укладке. Конформационные различия, которые сопровождают превращение между олигомерами, могут быть подобны белковым движениям, необходимым для функционирования некоторых белков. Модель морфеина подчеркивает важность конформационной гибкости для функциональности белков и предлагает возможное объяснение белков, демонстрирующих не- "Михаэлис-Ментен" кинетику, гистерезис и / или специфическую активность, зависящую от концентрации белка.
Значение для понимания структурной основы болезни
Термин «конформационное заболевание» обычно включает мутации, которые приводят к неправильной укладке белков, которые агрегируют такие болезни, как болезни Альцгеймера и Крейтцфельдта – Якоба. Однако в свете открытия морфеинов это определение может быть расширено, чтобы включить мутации, которые сдвигают равновесие альтернативных олигомерных форм белка. Примером такого конформационного заболевания является порфирия ALAD, которая возникает в результате мутации порфобилиногенсинтазы, которая вызывает сдвиг в ее морфеиновом равновесии.
Таблица белков, опубликованное поведение которых согласуется с поведением морфеина
Морфеины - это белки, которые могут образовывать два или более различных гомо-олигомера (формы морфеина), но должны распадаться и изменять форму для преобразования между формами. Альтернативная форма может собираться в другой олигомер. Форма субъединицы определяет, какой олигомер образуется. Каждый олигомер имеет конечное число субъединиц (стехиометрия). Морфеины могут взаимодействовать между формами в физиологических условиях и могут существовать в виде равновесия различных олигомеров. Эти олигомеры физиологически релевантны и не являются неправильно свернутым белком; это отличает морфеины от прионов и амилоида. Различные олигомеры обладают различной функциональностью. Взаимопревращение морфеиновых форм может быть структурной основой аллостерической регуляции.Мутация, которая изменяет нормальное равновесие форм морфеина, может служить основой для конформационного заболевания (Conformational Disease). Особенности морфеинов могут быть использованы для открытия лекарств. Изображение кубика (рис.1) представляет собой равновесие морфеина, содержащее две различные мономерные формы, которые диктуют сборку тетрамера или пентамера. Единственным белком, который, как установлено, функционирует как морфеин, является порфобилиногенсинтаза, хотя в литературе есть предположения, что другие белки могут функционировать как морфеины (для получения дополнительной информации см. "Таблицу предполагаемых морфеинов" ниже).
| Белок | Исследуемый вид | Шифр КФ | Номер CAS | Альтернативные олигомеры | Эффект |
|---|---|---|---|---|---|
| Ацетил-КоА карбоксилаза-1 | Gallus domesticus | Шифр КФ 6.4.1.2 | 9023-93-2 | неактивный димер, активный димер, больше | Эффекторные молекулы влияют на мультимеризацию, множественные / совместные функции белков. |
| α-ацетилгалактозаминидаза | Bos taurus | Шифр КФ 4.3.2.2 | 9027-81-0 | неактивный мономер, активный тетрамер | Связывание / обмен субстрата влияет на мультимеризацию, специфическую активность, зависящую от концентрации белка, разные сборки имеют разные активности, конформационно различные олигомерные формы. |
| Аденилосукцинатлиаза | Bacillus subtilis | Шифр КФ 4.3.2.2 | 9027-81-0 | мономер, димер, тример, тетрамер | Мутации сдвигают равновесие олигомеров, олигомер-зависимые кинетические параметры, зависимую от концентрации белка молекулярную массу |
| Аристолохенсинтаза | Penicillium roqueforti | Шифр КФ 4.2.3.9 | 94185-89-4 | мономер высшего порядка | Специфическая активность, зависящая от концентрации белка |
| L-аспарагиназа | Leptosphaeria michotii | Шифр КФ 3.5.1.1 | 9015-68-3 | димер, тетрамер, неактивный октамер | Связывание / оборот субстрата влияет на мультимеризацию |
| Аспартокиназа | Escherichia coli | Шифр КФ 2.7.2.4 & Шифр КФ 1.1.1.3 | 9012-50-4 | мономер, димер, тетрамер | Множественные / совместные белковые функции,Конформационно отличные олигомерные формы |
| АТФаза транспортера ABCA1 | Homo sapiens | димер, тетрамер | Связывание / оборот субстрата влияет на мультимеризацию. | ||
| Биотин - (ацетил-КоА-карбоксилаза) лигаза голофермент-синтетаза | Escherichia coli | Шифр КФ 6.3.4.15 | 37340-95-7 | мономер, димер | Множественные / совместные белковые функции, У разных сборок разные виды активности |
| Хоризмат мутаза | Escherichia coli | Шифр КФ 5.4.99.5 | 9068-30-8 | димер, тример, гексамер | Конформационно отличные олигомерные формы |
| Цитрат-синтаза | Escherichia coli | Шифр КФ 2.3.3.1 | 9027-96-7 | мономер, димер, тример, тетрамер, пентамер, гексамер, додекамер | Связывание / оборот субстрата влияет на мультимеризацию, характерное равновесие олигомеров, на специфическую активность, зависящую от концентрации белка, на pH-зависимое олигомерное равновесие |
| Циановирин-N | Nostoc ellipsosporum | 918555-82-5 | мономер и димер со сменой доменов | Характеризуется равновесием олигомеров, конформационно различных олигомерных форм | |
| 3-оксоацид КоА-трансфераза | Sus scrofa domestica | Шифр КФ 2.8.3.5 | 9027-43-4 | димер, тетрамер | Хроматографически разделяемые олигомеры, Субстрат может предпочтительно стабилизировать одну форму |
| Цистатионин бета-синтаза | Homo sapiens | Шифр КФ 4.2.1.22 | 9023-99-8 | несколько форм в диапазоне от димера до 16-мера | Эффекторные молекулы влияют на мультимеризацию, Мутации сдвигают равновесие олигомеров, Различные сборки обладают разной активностью, вызывающие болезни-мутации в сайтах, удаленных от активного сайта. |
| Оксидаза D-аминокислот | Шифр КФ 1.4.3.3 | 9000-88-8 | мономеры, димеры, олигомеры высшего порядка | Олигомер-зависимые кинетические параметры. | |
| Дигидролипоамид-дегидрогеназа | Sus scrofa domestica | Шифр КФ 1.8.1.4 | 9001-18-7 | мономер, две различные формы димера, тетрамер | Множественные / совместные белковые функции, Различные сборки имеют разные активности, pH-зависимое олигомерное равновесие, конформационно различные олигомерные формы. |
| Дофамин бета-монооксигеназа | Bos taurus | Шифр КФ 1.14.17.1 | 9013-38-1 | димеры, тетрамеры | Эффекторные молекулы влияют на мультимеризацию, Характеризованное равновесие олигомеров, Олигомер-зависимые кинетические параметры |
| Геранилгеранилпирофосфатсинтаза / Фарнезилтрантрансфераза | Homo sapiens | Шифр КФ 2.5.1.29 | 9032-58-0 | гексамер, октамер | Эффекторные молекулы влияют на мультимеризацию |
| ГДФ-манноза 6-дегидрогеназа | Pseudomonas aeruginosa | Шифр КФ 1.1.1.132 | 37250-63-8 | тример, 2 тетрамера и гексамер | Специфическая активность, зависящая от концентрации белка, кинетический гистерезис |
| Глутаматдегидрогеназа | Bos taurus | Шифр КФ 1.4.1.2 | 9001-46-1 | активные и неактивные гексамеры высшего порядка | Эффекторные молекулы влияют на мультимеризацию, характеризует равновесие олигомеров |
| Глутамат рацемаза | Mycobacterium tuberculosis, Escherichia coli, Bacillus subtilis, Aquifex pyrophilus | Шифр КФ 5.1.1.3 | 9024-08-02 | мономер, 2 димера, тетрамер | Множественные / совместные белковые функции, Характеризованное равновесие олигомеров, Конформационно различные олигомерные формы |
| Глицеральдегид-3-фосфатдегидрогеназа | Oryctolagus cuniculas, Sus scrofa domestica | Шифр КФ 1.2.1.12 | 9001-50-7 | мономер, димер, тетрамер Характеризуемое равновесие олигомеров, У разных форм разные виды активности | |
| Глицерин киназа | Escherichia coli | Шифр КФ 2.7.1.30 | 9030-66-4 | мономер и 2 тетрамера | Характеризованное равновесие олигомеров, Конформационно отличные олигомерные формы, Эффекторные функции, предотвращающие движение домена |
| ВИЧ-интеграза | Human immunodeficiency virus-1 | Шифр КФ 2.7.7.- | мономер, димер, тетрамер, высшего порядка. | Эффекторные молекулы влияют на мультимеризацию, Множественные / белковые функции совместных действий, Различные сборки имеют разную активность | |
| HPr-киназа / фосфатаза | Bacillus subtilis, Lactobacillus casei, Mycoplasma pneumoniae, Staphylococcus xylosus | Шифр КФ 2.7.1.-/Шифр КФ 3.1.3.- | 9026-43-1 | мономеры, димеры, тримеры, гексамеры | Эффекторные молекулы влияют на мультимеризацию, множественные / совместные белковые функции, разные сборки имеют разную активность, pH-зависимое олигомерное равновесие |
| Лактатдегидрогеназа | Bacillus stearothermophilus | Шифр КФ 1.1.1.27 | 9001-60-9 | 2 димера, тетрамер | Эффекторные молекулы влияют на мультимеризацию, Характеризованное равновесие олигомеров, Специфическую активность, зависящую от концентрации белка, Мутации сдвигают равновесие олигомеров, Олигомер-зависимые кинетические параметры, Конформационно отличные олигомерные формы |
| Lon протеаза | Escherichia coli, Mycobacterium smegmatis | Шифр КФ 3.4.21.53 | 79818-35-2 | мономер, димер, тример, тетрамер | Эффекторные молекулы влияют на мультимеризацию, связывание / оборот субстрата влияет на мультимеризацию, специфическая активность, зависящая от концентрации белка, кинетический гистерезис |
| Митохондриальный НАД (Ф) + яблочный фермент / малатдегидрогеназа (оксалоацетат-декарбоксилирование) (НАДФ +) | Homo sapiens | Шифр КФ 1.1.1.40 | 9028-47-1 | мономер, 2 димера, тетрамер | Эффекторные молекулы влияют на мультимеризацию, Мутации сдвигают равновесие олигомеров, Кинетический гистерезис, |
| Пероксиредоксины | Salmonella Typhimurium | Шифр КФ 1.6.4.- & Шифр КФ 1.11.1.15 | 207137-51-7 | 2 димера, декамер | Конформационно различные олигомерные формы, Различные сборки имеют разную активность |
| Фенилаланингидроксилаза | Homo sapiens | Шифр КФ 1.14.16.1 | 9029-73-6 | тетрамер высокой активности, тетрамер низкой активности. | Связывание / оборот субстрата влияет на мультимеризацию, конформационно отличные олигомерные формы |
| Фосфоенолпируваткарбоксилаза | Escherichia coli, Zea mays | Шифр КФ 4.1.1.31 | 9067-77-0 | неактивный димер, активный тетрамер | Эффекторные молекулы влияют на мультимеризацию, характерное равновесие олигомеров, кинетический гистерезис, конформационно отличные олигомерные формы |
| Фосфофруктокиназа | Bacillus stearothermophilus, Thermus thermophilus | Шифр КФ 2.7.1.11 | 9001-80-3 | неактивный димер, активный тетрамер | Эффекторные молекулы влияют на мультимеризацию, Характеризуется равновесием олигомеров |
| Полифенолоксидаза | Agaricus bisporus, Malus domestica, Lactuca sativa L. | Шифр КФ 1.10.3.1 | 9002-10-2 | мономер, тример, тетрамер, октамер, додекамер | Множественные / совместные белковые функции, Связывание / оборот субстрата влияет на мультимеризацию, Различные сборки имеют разную активность, Кинетический гистерезис |
| Порфобилиногенсинтаза | Drosophila melanogaster, Danio rerio | Шифр КФ 4.2.1.24 | 9036-37-7 | димер, гексамер, октамер | PBGS - прототип морфеина. |
| Пируваткиназа | Homo sapiens | Шифр КФ 2.7.1.40 | 9001-59-6 | активные и неактивные димеры, активный тетрамер, мономер, тример, пентамер | Конформационно отличные олигомерные формы |
| Рибонуклеаза А | Bos taurus | Шифр КФ 3.1.27.5 | 9901-99-4 | мономер, димер, тример, тетрамер, гексамер, пентамер высшего порядка | Множественные / совместные функции белков, Различные сборки имеют разные активности, Конформационно различные олигомерные формы |
| Рибонуклеотидредуктаза | Mus musculus | Шифр КФ 1.17.4.1 | 9047-64-7 | тетрамер, гексамер | Эффекторные молекулы влияют на мультимеризацию. |
| S-аденозил-L-гомоцистеин гидролаза | Dictyostelium discoideum | Шифр КФ 3.3.1.1 | 9025-54-1 | тетрамер и др. | Эффекторные молекулы влияют на мультимеризацию. |
| Биодегративная треониндегидратаза / треонинаммиак-лиаза | Escherichia coli | Шифр КФ 4.3.1.19 | 774231-81-1 | 2 мономера, 2 тетрамера | Эффекторные молекулы влияют на мультимеризацию., Характерное равновесие олигомеров, Различные сборки обладают разной активностью |
| β-триптаза | Homo sapiens | Шифр КФ 3.4.21.59 | 97501-93-4 | активные и неактивные мономеры, активные и неактивные тетрамеры | Удельная активность, зависящая от концентрации белка, характеризует равновесие олигомеров |
| Фактор некроза опухоли альфа | Homo sapiens | 94948-61-5 | мономер, димер, тример | Различные сборки обладают разной активностью | |
| Урацил фосфорибозилтрансфераза | Escherichia coli | Шифр КФ 2.4.2.9 | 9030-24-4 | тример, пентамер | Эффекторные молекулы влияют на мультимеризацию, Связывание / оборот субстрата влияет на мультимеризацию, Различные сборки имеют разную активность |
| Активность | |
|---|---|
| Регуляция | |
| Классификация | |
| Типы |
|
