
Метанол
| Метанол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Метанол | ||
| Традиционные названия | Метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила | ||
| Хим. формула | CH4O | ||
| Рац. формула | СН3OH | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 32,04 г/моль | ||
| Плотность | 0,7918 г/см³ | ||
| Динамическая вязкость | 5.9×10−4 Па·с | ||
| Энергия ионизации | 10,84 ± 0,01 эВ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -97 °C | ||
| • кипения | 64,7 °C | ||
| • разложения | 320-380 °C | ||
| • вспышки | 6 °C | ||
| • воспламенения | 13 °C | ||
| • самовоспламенения | 440 °C | ||
| Пределы взрываемости | 6,98-35,5 % | ||
| Тройная точка | 175,45 K (−97,7°C) | ||
| Критическая точка | 513,15 K (240 °C), 7,85 МПа | ||
| Энтальпия | |||
| • образования | -238 кДж/моль | ||
| • сгорания | −726,4 кДж/моль | ||
| • плавления | 3167,29 ± 0,01 Дж/моль | ||
| • кипения | 37 400 Дж/моль | ||
| Удельная теплота испарения | 37,4 кДж/моль | ||
| Давление пара | 11,8 кПа (при 20 °С) | ||
| Химические свойства | |||
Константа диссоциации кислоты 
|
~15,5 | ||
| Структура | |||
| Дипольный момент | 1,65 Д | ||
| Классификация | |||
| Рег. номер CAS | 67-56-1 | ||
| PubChem | 887 | ||
| Рег. номер EINECS | 200-659-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | PC1400000 | ||
| ChEBI | 17790 | ||
| Номер ООН | 1230 | ||
| ChemSpider | 864 | ||
| Безопасность | |||
| Предельная концентрация | 5 мг/м³ (рекомендуемая) | ||
| Токсичность | Зарегистрированные препараты метанола относятся к 3-му классу опасности для человека, вызывают общетоксическое действие. | ||
| Краткие характер. опасности (H) |
H225, H301+H311+H331, H370
|
||
| Меры предостор. (P) |
P210, P260, P280, P301+P310, P311
|
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила, CH3OH) — органическое вещество, простейший представитель гомологического ряда одноатомных спиртов, бесцветная жидкость с запахом этилового спирта. Опасный для человека яд, контаминант.
Метанол смешивается в любых соотношениях с водой и с большинством органических растворителей.
Смеси метанола с воздухом в объёмных концентрациях 6,98–35,5 % метанола взрывоопасны, температура вспышки — 8 °C.
Содержание
История
Метанол был впервые обнаружен Бойлем в 1661 году в продуктах сухой перегонки древесины. Через два столетия, в 1834 году, его выделили в чистом виде Ж. Б. Дюма и Э. М. Пелиго. Тогда же была установлена химическая формула метанола. В 1857 году Бертло получил метанол омылением метилхлорида.
Физические свойства
Метанол — бесцветная жидкость с резковатым запахом этилового спирта. Температура кипения +64,7 °C.
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Перкин); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Диттмар и Фоусет). Капиллярная постоянная при температуре кипения a² = 5,107 (Шифф); Критическая температура 241,9° (Шмидт). Упругость паров при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зелёное окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO4∙5H2O (Клепль).
Метанол (в отличие от этанола) с водой не образует азеотропной смеси, в результате чего смеси вода-метанол могут быть разделены ректификационной перегонкой.
| Молярная доля метанола % | Температура кипения при 760 мм рт. ст., °C |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
Химические свойства
Метанол даёт со многими солями соединения, подобные кристаллогидратам (сольваты), например: CuSO4 ∙ 2СН3ОН; LiCl ∙ 3СН3ОН; MgCl2 ∙ 6СН3ОН; CaCl2 ∙ 4СН3ОН представляет собой шестисторонние кристаллы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane). Соединение ВаО ∙ 2СН3ОН ∙ 2Н2O получается в виде блестящих призм при растворении ВаО в водном метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6СН3ОН; 3KOH ∙ 5СН3OH (Геттиг). При действии металлических калия и натрия легко даёт алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду.
При пропускании паров метанола через докрасна накалённую трубку получается C2H2 и другие продукты (Бертло). При пропускании паров метанола над накалённым цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn). Медленное окисление паров метанола при помощи раскалённой платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН3ОН+О2=2НСНО+2Н2О. При действии хлористого цинка и высокой температуры метанол даёт воду и алканы, а также небольшие количества гексаметилбензола (Лебедь и Грин). Метанол, нагретый с нашатырём в запаянной трубке до 300°, даёт моно-, ди- и триметиламины (Бертло).
При пропускании паров метанола над KOH при высокой температуре выделяется водород и образуются последовательно формиат, ацетат и, наконец, карбонат калия.
Концентрированная серная кислота даёт метилсерную кислоту CH3HSO4, которая при дальнейшем нагревании с метанолом даёт метиловый эфир. При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH3)2SO4. При действии серного ангидрида SO3 получается CH(OH)(SO3H)2 и CH2(SO3H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы даёт хлорметан СН3Cl. Действием HBr и H2SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол даёт СО2, СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН2(ОСН3)2 (Ренар). При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
Токсичность
Метиловый спирт — опасный яд. Действует преимущественно на нервную и сердечно-сосудистую систему, обладает выраженной способностью к кумуляции. LD50 для животных — от единиц до десятка г/кг. У человека приём внутрь 5—10 мл метанола и более может приводить к тяжёлому отравлению, 30 мл могут вызвать смертельный исход, попадание в организм более 80—150 миллилитров метанола (1—2 миллилитра чистого метанола на килограмм тела) обычно смертельно. Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред.
Хотя наиболее опасен приём метанола внутрь, отравление возможно также при вдыхании его паров и при контакте метанола с неповреждённой кожей, в частности, при сильном загрязнении метанолом одежды. Характерным проявлением острого отравления метанолом является ухудшение зрения вплоть до слепоты. Хронические отравления поражают сосуды головного мозга и глаз, что приводит к дегенеративным изменениям этих органов и также сопровождается ухудшением зрения, в первую очередь цветного. Отравления метанолом приводят к дистрофическим изменениям клеток печени и как следствие — к функциональной недостаточности печени, сохраняющейся после клинического выздоровления.
В США максимальное допустимое суточное употребление метанола (референтная доза), подразумевая несвязанное с какими-либо эффектами на здоровье, установлено в размере 2 мг на кг веса тела (с 1988 года).
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³ (рекомендуемая). Для сравнения, у изопропилового спирта: 10 мг/м³, у этанола — 1000 мг/м³), ПДК в воздухе населённых мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³. При этом порог восприятия запаха этого вещества у отдельных лиц может достигать 7800 мг/м³.
Наиболее лёгкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой, умеренными расстройствами зрения вплоть до временной слепоты.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками. Происходит так называемый летальный синтез.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь.
При отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола и, как следствие, снижением скорости окисления метанола до формальдегида. Однако при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление 1,2-дихлорэтаном или четырёххлористым углеродом — в этом случае введение этилового спирта опасно.
Также антидотом метанола может выступать 4-метилпиразол, вводимый внутривенно.
Отравления метанолом довольно часты. Так, в США в течение 2013 года зафиксировано 1747 случаев.
Массовые отравления метанолом
Известно множество массовых отравлений метанолом. Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей; контрафактный алкоголь; метанол, выдаваемый за этиловый спирт.
- Массовое отравление метанолом в Испании в начале 1963 года; официальное число погибших 51 человек, однако существуют оценки в диапазоне от 1000 до 5000 человек.
- Массовое отравление метанолом в Бангалоре (Индия) в июле 1981 года. Число погибших — 308 человек.
- Массовое отравление метанолом в Италии весной 1986 года; погибли 23 человека.
- Массовое отравление метанолом в Сальвадоре в октябре 2000 года вызвало смерть 122 человек. Власти подозревали теракт, поскольку в спиртных напитках на заводах-производителях метанол при расследовании инцидента не был выявлен.
- Массовое отравление метанолом 9—10 сентября 2001 года в городе Пярну (Эстония); 68 человек погибли.
- Массовое отравление метанолом в Чехии, Польше и Словакии в сентябре 2012 года; 51 человек погиб.
- Массовое отравление метанолом 17—20 декабря 2016 года в Иркутске (Россия). Пострадало 123 человека, 76 из них умерли.
- 2020 год. В мусульманском Иране, где употребление алкоголя строго запрещено законами шариата, около 300 человек умерли и более 1000 получили ущерб здоровью разной степени тяжести после того, как выпили метанола для «лечения» или «профилактики» коронавирусной болезни.
- 2021 год, октябрь — массовое отравление суррогатным алкоголем в Оренбургской области; на 13 октября известно о 35 погибших.
- 2021 год, октябрь. От контрафактного алкоголя с метанолом умерло 44 человека в Екатеринбурге, Нижнем Тагиле и Ревде.
Предотвращение отравлений метанолом
С помощью денатурации возможно сделать метанол непригодным для питья. Применение горького вещества битрекс в метаноле применяется в некоторых штатах США. Предложения по денатурации метанола в Российской Федерации в 2006 году, 2017 году, в августе 2021 года не были законодательно приняты.
Нахождение в природе
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты С6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например среди природных красителей, алкалоидов и тому подобных.
В небольших количествах метанол вырабатывается в организме человека. Обнаружено 2 источника:
- Микрофлора кишечника;
- Метаболизм пектина.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удаётся почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
В космическом пространестве метанола немного, зато в его скоплениях возникает эффект мазера, что позволило астрономам провести прямые измерения фундаментальных постоянных Вселенной.
Получение
Известно несколько способов получения метанола: сухая перегонка древесины и лигнина, термическое разложение солей муравьиной кислоты, синтез из метана через метилхлорид с последующим омылением, неполное окисление метана и получение из синтез-газа. Первоначально в промышленности был освоен метод получения метанола сухой перегонкой древесины, но впоследствии он потерял своё промышленное значение. Современное производство метанола из монооксида углерода и водорода впервые было осуществлено в Германии компанией BASF в 1923 году. Процесс проводился под давлением 10—35 МПа на цинк-хромовом катализаторе (ZnO/Cr2O3) при температуре 320—450 °CКараханов, 1997. Впоследствии распространение получил разработанный в Англии способ синтеза метанола на медьсодержащих катализаторах, промотированных цинком, хромом и другими добавками, при температуре 200—300 °C и давлении 5—10 МПа.
Современный промышленный метод получения — синтез из оксида углерода(II) и водорода на медь-цинковом оксидном катализаторе при следующих условиях:
- температура — 250 °C;
- давление — 7 МПа (= 69,08 атм = 70 Бар = 71,38 кгс/см²).
Схема механизма каталитического получения метанола сложна и суммарно может быть представлена в виде реакции:
Синтезы на основе оксида углерода и водорода:
| Процесс | Катализатор | Носитель катализатора | Температура, °С | Давление, МПа | Продукт |
|---|---|---|---|---|---|
| Синтез метана | Ni | ThO2 или MgO | 250—500 | 0,1 | Метан |
| Синтез метанола | ZnO, Cr2O3, CuO | — | 200—400 | 5—30 | Метанол |
| Синтез высших спиртов | Fe, Fe-Cr, Zn-Cr | Al2O3, NaOH | 180—220,
380—490 |
1—3, 15—25 | Метанол и высшие спирты |
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В настоящее время этот способ неактуален.
Компания BASF разработала способ получения изобутилового спирта, основанный на каталитическом гидрировании монооксида углерода и приводящий к образованию смеси, содержащей 50 % метанола и 11—14 % 2-метилпропанола-1, а также другие продукты. BASF прекратила производить изобутиловый спирт этим методом после разработки оксосинтеза и нефтехимического пути синтеза изобутанола.
Производство метанола:
| Год | США | Германия | Мир, тыс. т | Цена продажи, $/т |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры застывания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства полимерных материалов,— в основном для получения карбамидоформальдегидных и фенолформальдегидных, карбамидных, меламиновых и других синтетических смол, а в последнее время — и нового пластического материала — полиформальдегида, отличающегося высокой механической прочностью, химической стойкостью и лёгкостью переработки.

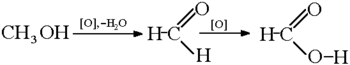
Формальдегид производится в промышленности каталитическим окислением метанола. Наиболее распространёнными катализаторами являются металлическoe серебро (в присутствии кристаллов серебра) или смесь оксидов железа и молибдена или ванадия. В обычно используемом «процессе формокса» метанол и кислород вступают в реакцию приблизительно при 250—400 °C в присутствии оксида железа в сочетании с молибденом и / или ванадием для получения формальдегида в соответствии с химическим уравнением:
Катализатор на основе серебра обычно работает при более высокой температуре, около 650 ° С. Две химические реакции на нём одновременно производят формальдегид: это реакция показан. выше и реакция дегидрирования:
В принципе, формальдегид может быть получен путём окисления метана, но этот путь не является промышленно целесообразным, поскольку метанол легче окисляется, чем метан.
Значительные количества CH3OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания.
Благодаря высокому октановому числу, позволяющему увеличить степень сжатия до 16, увеличивая тем самым удельную мощность двигателя; метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии.
В России использование метанола в потребительских товарах ограничено в связи с его токсичностью.
В России ограничено использование метилового спирта в средствах по уходу за автотранспортом, а также продажа населению указанных средств, содержащих метанол.
Используется в топливных элементах. Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду, где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду, снабжая энергией внешнюю нагрузку.
Реакции:
На аноде
На катоде
Общая для топливного элемента:
Важным потребителем метанола является промышленный синтез уксусной кислоты каталитическим карбонилированием моноксидом углерода (процесс Монсанто), которое происходит по формальному уравнению:
В качестве катализатора ив процессе используются соли родия в комбинации с йодидом, образующие in situ каталитический комплекс [Rh(CO)2I2]-. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2—3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38—53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол):
Метил-трет-бутиловый эфир (C5H12O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
Отдельным направлением является использование метанола для переэтерификации жиров в производстве биодизеля. Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Метанол в бензин
Метанол в бензин, (Methanol-to-Gasoline сокращённо MTG) , — это химический процесс производства бензина из метанола.
Процесс полезен для производства бензина из природного газа или угля вместо нефти . Процесс был разработан в 1970-х годах компанией Mobil (сейчас ExxonMobil). Уголь или природный газ сначала превращается в синтез-газ, а затем в метанол. Затем метанол дегидратируют до диметилового эфира (ДМЭ). Затем диметиловый эфир дополнительно дегидратируют на катализаторе. Химическая реакция протекает следующим образом:

Степень превращения метанола в углеводороды с пятью или более атомами углерода составляет 80 %. Катализатором обычно является цеолит, например ZSM-5. ZSM-5 теряет свою активность из-за накопления углерода. Затем катализатор необходимо регенерировать путём выжигания углерода при 500 ° С. Количество возможных регенераций ограничено, и в конечном итоге катализатор необходимо заменить.
Из 1000 тонн метанола в процессе будет получено 387 тонн бензина, 46 тонн сжиженного нефтяного газа, 7 тонн топливного газа и 560 тонн воды, которая рециркулируeтся в качестве технической воды.
Гомологизация метанола
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанолКараханов, 1997:
Реакция гомологизации по своему механизму близка реакции гидроформилирования алкенов, с помощью модифицированных катализаторов кобальта и рутения и добавления йодид-ионов в качестве промоторов в реакции удаётся добиться выхода этанола 90 %Караханов, 1997.
Исходный метанол также получают из окиси углерода на катализаторе на основе оксидов меди и цинка при давлении 5—10 МПа и температуре 250 °CКараханов, 1997.
Общая схема выглядит следующим образом:
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Её привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
Биометанол
Промышленное разведение морского фитопланктона рассматривалось на рубеже 1980-х как одно из наиболее перспективных направлений в области получения биотоплива.
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола.
Основными доводами в пользу использования микроскопических водорослей являются следующие:
- высокая продуктивность фитопланктона (до 100 т/га в год);
- в производстве не используются ни плодородные почвы, ни пресная вода;
- процесс не конкурирует с сельскохозяйственным производством;
- энергоотдача процесса достигает 14 джоулей на стадии получения метана и 7 джоулей на стадии получения метанола;
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
Метанол в качестве топлива
Объёмная и массовая энергоёмкость (теплота сгорания) метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40—50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряжённости, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого мощность двигателя повышается на 7—9 %, а крутящий момент на 10—15 %. Двигатели гоночных автомобилей, работающих на метаноле с более высоким октановым числом, чем бензин, имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11,5:1. Метанол может использоваться как в классических ДВС, так и в специальных топливных элементах для получения электричества.
При работе классического ДВС на метаноле происходит увеличение индикаторного КПД по сравнению с его работой на бензине. Такой прирост вызван снижением тепловых потерь и может достигать единиц процентов.
| Топливо | Плотность энергии | Смесь воздуха с топливом | Удельная энергия смеси воздуха с топливом | Удельная теплота испарения | Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| Бензин | 32 МДж/л | 14,6 | 2,9 МДж/кг воздух | 0,36 МДж/кг | 91—99 | 81—89 |
| Бутанол-1 | 29,2 МДж/л | 11,1 | 3,2 МДж/кг воздух | 0,43 МДж/кг | 96 | 78 |
| Этанол | 19,6 МДж/л | 9,0 | 3,0 МДж/кг воздух | 0,92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6,4 | 3,1 МДж/кг воздух | 1,2 МДж/кг | 156 | 92 |
- Недостатки
- Метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырцу, содержащему значительные количества примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащий воду, начинает реагировать с алюминием при температуре выше 50 °C, а с обычной углеродистой сталью не реагирует вовсе.
- Гидрофильность. Метанол втягивает воду, что является причиной расслоения топливных смесей бензин-метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, могут иметь проблемы с запуском при температуре ниже +10 °C и отличаться повышенным расходом топлива до достижения рабочей температуры. Данная проблема, однако, легко решается добавлением в метанол 10—25 % бензина.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемом в Европе. Сегодня в Китае используется более 1000 млн галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средствах, а также высокоуровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии, которая в США имеет коммерческое наименование «метакол» (methacoal). Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут). Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоёмкость. С экологической точки зрения такое топливо имеет меньший «углеродный след», чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.
Применение в качестве авиационного и ракетного топлива
Во время Второй мировой войны Германия использовала метанол в качестве топлив и присадок к топливу, для нужд люфтваффе. Система форсирования авиационного поршневого двигателя MW 50 представлялa собой смесь 50 % воды и 50 % метанола которая распылялась в нагнетатель авиационных двигателей, главным образом из-за её антидетонационного эффекта, позволяя создавать большее давление в цилиндрах. Её побочным эффектом было внутреннее охлаждение двигателя.
Эффект применения MW 50 был значительным. Простое включение системы позволяло двигателю поглотить больше воздуха, благодаря охлаждающему эффекту, тем самым увеличивая производительность примерно на 100 л. с. для двигателей BMW 801 и DB 605. В дополнение к этому MW-50 позволял нагнетателю работать на более высокой скорости и давлении, вызывая комбинированное увеличение мощности двигателей до 500 л. с. (для двигателей Юнкерс Юмо 211).
Немецкий ракетный истребитель-перехватчик времён Второй мировой войны Me-163 имел жидкостный ракетный двигатель, в который подавалась 80-процентная перекись водорода и жидкий катализатор (раствор перманганата калия либо смесь метанола, гидразин-гидрата и воды). В камере сгорания перекись водорода разлагалась с образованием большого объёма перегретой парогазовой смеси, создавая мощную реактивную тягу.
См. также
Литература
- Розенгарт В. И.; Егоров Ю. Л., Бережной P. В. (суд.). Метиловый спирт // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1981. — Т. 15 : Меланома — Мудров. — С. 108—110. — 576 с. : ил.
- ГОСТ 2222-95 : Метанол технический
- Спирты // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Караханов, Э. А. Синтез-газ как альтернатива нефти : Ч. II. Метанол и синтезы на его основе : [арх. 17 ноября 2018] // Соросовский образовательный журнал. — 1997. — № 12. — С. 65—69.
- Methanol: Systemic Agent : [англ.] : [арх. 23 апреля 2009] / Content source: National Institute for Occupational Safety and Health (NIOSH) // CDC. — 2011. — 12 May.
- Умнов, И. Измерение фундаментальных постоянных при помощи метанола // Star Mission. — 2011. — 14 июня.
Ссылки
- Мингазов, Г. Метанол убивает человека и природу // Беллона. — 2007. — 13 июля.
- Производство метанола // Фоксфорд.
| (0°) | |
|---|---|
| Первичные спирты (1°) | |
| Вторичные спирты (2°) | |
| Третичные спирты (3°) | |
|
Основные виды органического топлива
| |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
|
||||||||
| Возобновляемое и биологическое |
|||||||||
| Искусственное | |||||||||
| ||||















![{\displaystyle {\mathsf {CH_{3}OH+CO+2H_{2}{\xrightarrow[{}]{Co_{2}(CO)_{8}}}CH_{3}CH_{2}OH+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/760f54c2e99471b3db6270ec2277f515140129ce)
![{\displaystyle {\mathsf {C+H_{2}O\rightarrow CO+H_{2}{\xrightarrow[{-H_{2}O}]{CO+H_{2}}}CH_{3}CH_{2}OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd5e7c1f61a3561110a7c4b551eb2aea4d1752bc)