Диоксид хлора
| Диоксид хлора | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Оксид хлора(IV) | ||
| Традиционные названия | Диоксид хлора; двуокись хлора | ||
| Хим. формула | ClO2 | ||
| Рац. формула | ClO2 | ||
| Физические свойства | |||
| Состояние | газ | ||
| Молярная масса | 67,45 г/моль | ||
| Плотность | 1,6 ± 0,1 г/см³ | ||
| Энергия ионизации | 10,36 ± 0,01 эВ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −59 °C | ||
| • кипения | 9,7 °C | ||
| Энтальпия | |||
| • образования | +104,60 кДж/моль | ||
| Давление пара | 1 ± 1 атм | ||
| Классификация | |||
| Рег. номер CAS | 10049-04-4 | ||
| PubChem | 24870 | ||
| Рег. номер EINECS | 233-162-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO3000000 | ||
| ChEBI | 29415 | ||
| ChemSpider | 23251 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м³ | ||
| ЛД50 | 140-149,2 мг/кг | ||
| Токсичность | Класс опасности 2 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
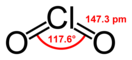
Диоксид хлóра (оксид хлора(IV), двуóкись хлóра) — неорганическое химическое соединение хлора и кислорода, формула: ClO2.
Содержание
Физические свойства
В стандартных условиях ClO2 — ядовитый газ жёлтого цвета с характерным запахом. При температурах ниже 10 °C ClO2 представляет собой жидкость красно-коричневого цвета, в твёрдом виде — красновато-жёлтый.
Малоустойчив, взрывается на свету, при контактах с восстановителями и при нагревании. Хорошо растворим в воде. Теплота испарения диоксида хлора 6,3 ± 0,1 ккал/моль, критическая температура 192 °C, критическое давление 85 атм. Плотность ClO2 уменьшается от 1,973 г/см³ при −60 °C до 1,653 г/см³ при 5 °C. Диоксид хлора растворим в воде, уксусной и серной кислотах, в четырёххлористом углероде, ацетонитриле, а также в ряде других органических растворителей. Растворимость диоксида хлора возрастает с ростом полярности растворителя. Потенциал ионизации диоксида хлора равен 10,33 ± 0,02 эВ, сродство к электрону 2,378 ± 0,006 эВ. Потенциал окисления-восстановления в водном растворе — E(ClO2/ClO2−) = 0,94 В.
Оксид хлора(IV) имеет нечётное количество электронов (33) и является стабильным радикалом, не проявляющим при нормальных условиях тенденции к димеризации. В газовой фазе ЭПР спектр ClO2 не наблюдается, что объясняется большим числом вращательных уровней его молекулы. ЭПР-спектр раствора оксида хлора(IV) представляет собой широкий синглет, но при некоторых условиях (например, низких температурах) спектральная линия усложняется, превращаясь в широкий квартет вследствие сверхтонкого расщепления на ядрах хлора 35Cl и 37Cl, для которых константы сверхтонкой структуры равны 1,70 ± 0,03 и 1,37 ± 0,03 мT соответственно.
Получение
Реакция хлора с кислородом под действием ультрафиолета:
В лаборатории диоксид хлора получают по реакции хлората калия со щавелевой кислотой:
Промышленный метод получения ClO2 основан на реакции восстановления хлората натрия диоксидом серы:
Хранить диоксид хлора в жидком виде сложно ввиду его малой устойчивости и взрывоопасности. В случаях, когда это необходимо, возможно кратковременное хранение в открытом охлаждаемом сосуде. Более устойчивыми являются его растворы в чистой воде и четырёххлористом углероде, сохраняемые при низких температурах. Возможно также довольно долгое хранение в адсорбированном виде: при низкой температуре и с использованием в качестве сорбента силикагеля, который одновременно позволяет освободить диоксид хлора от значительных примесей слабо сорбирующегося в этих условиях элементного хлора, а также воды, прочно удерживаемой силикагелем после высвобождения сорбата при подогревании.
Свойства
Кислотный оксид. При растворении в воде медленно образуются хлористая и хлорноватая кислоты (реакция диспропорционирования):
Разбавленные растворы, устойчивые в темноте, на свету медленно разлагаются. Образующаяся хлористая кислота очень неустойчива и разлагается:
ClO2 реагирует со многими органическими соединениями как окислитель средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием на первой стадии реакции органических катион-радикалов и хлорит-иона, но возможно протекание и других реакций, в частности, реакции отрыва атома водорода.
Применение
Используется в основном для отбеливания, например, целлюлозы, бумаги, муки и тому подобного, дезинфекции и стерилизации различных материалов. С 2010 года началось применение в США в качестве компонентов зубных паст и ополаскивателей в связи с высокой активностью против бактериальных биоплёнок, создаваемых анаэробными бактериями (CloSYS, TheraBreath). В России аэрозоль диоксида хлора используется для дезинфекции медицинских учреждений и рассматривается в качестве дезинфектанта для транспорта (GreenDez).
Физиологическое действие
Диоксид хлора ядовит. Сильный окислитель. Вызывает раздражение слизистых оболочек и кашель. ПДК в воздухе рабочей зоны 1 мг/м3, ЛД50 = 140—149,2 мг/кг (крысы, перорально).
Вещество относится ко II классу токсичности в соответствии с ГОСТ 12.1.005-76.
В окислительно-восстановительных реакциях молекула хлора способна принять два электрона, а молекула диоксида хлора — пять. В диоксиде хлора электроны принимают атомы кислорода, у хлора — только атомы хлора, и это приводит к заметным различиям в свойствах этих веществ. Реакция между хлором и органическими веществами приводит к присоединению к молекулам последних атомов хлора с образованием токсичных хлорорганических соединений. Диоксид хлора отдаёт органическим веществам в ходе реакции атомы кислорода и по этой причине менее опасен, чем чистый хлор. Именно поэтому диоксид хлора начал активно заменять традиционное хлорирование воды на станциях водоочистки по всему миру (в первую очередь в США). Для обеззараживания того же количества воды нужно меньшее количество диоксида хлора по сравнению с обычным хлором. Кроме того, в такой воде отсутствуют хлорорганические соединения, так как при распаде молекулы диоксида хлора не образуется активный хлор, способный вступать в реакции, поэтому диоксид хлора разрешён для применения в качестве антибактериального агента.
Злоупотребление
Продается под названием Miracle Mineral Supplement (MMS) — это токсичный раствор 28 % хлорита натрия вместе с 10 % активатором, раствора лимонной кислоты. Новатором снадобья MMS, которое якобы исцеляет почти от всех болезней, считается оккультист Джим Хамбл, основавший секту Genesis II, Church of Health & Healing (Второе творение: церковь здоровья и исцеления).
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.