Глюконеогенез
Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений (в частности, пирувата). Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы. Глюконеогенез является обязательной частью цикла Кори, кроме того, этот процесс может быть использован для превращения пирувата, образованного при дезаминировании аминокислот аланина и серина.
Суммарное уравнение глюконеогенеза выглядит следующим образом:
Глюконеогенез протекает в основном в печени, но менее интенсивно он протекает также в корковом веществе почек и слизистой кишечника.
Глюконеогенез и гликолиз регулируются реципрокно: если клетка снабжена энергией в достаточной степени, то гликолиз приостанавливается, и запускается глюконеогенез; напротив, при активизации гликолиза происходит приостановление глюконеогенеза.
Содержание
Общий обзор
Глюконеогенез происходит у животных, растений, грибов и микроорганизмов. Его реакции одинаковы для всех тканей и биологических видов. Важными предшественниками глюкозы у животных выступают трёхуглеродные соединения, такие как лактат, пируват, глицерол, а также некоторые аминокислоты. У млекопитающих глюконеогенез происходит главным образом в печени, в меньшей степени — в корковом слое почек и эпителиальных клетках, выстилающих тонкую кишку. Образованная в ходе глюконеогенеза глюкоза уходит в кровь, откуда доставляется к другим тканям. После интенсивной физической работы лактат, образовавшийся при анаэробном гликолизе в скелетных мышцах, возвращается в печень и превращается там в глюкозу, которая снова поступает в мышцы или превращается в гликоген (этот круговорот известен как цикл Кори). У проростков растений запасённые в семени жиры и белки превращаются, в том числе и через глюконеогенез, в дисахарид сахарозу, который транспортируется по всему развивающемуся растению. Глюкоза и её производные служат предшественниками для синтеза растительной клеточной стенки, нуклеотидов, коферментов и многих других жизненно важных метаболитов. У многих микроорганизмов глюконеогенез начинается с простых органических соединений, содержащих два или три атома углерода, например, ацетата, лактата и пропионата, которые содержатся в питательной среде.
Хотя реакции глюконеогенеза одинаковы у всех организмов, соседние метаболические пути и регуляторные пути глюконеогенеза отличаются у различных видов и в различных тканях. В этой статье рассмотрены особенности глюконеогенеза млекопитающих; о механизмах синтеза глюкозы растениями из первичных продуктов фотосинтеза см. Фотосинтез.
Глюконеогенез и гликолиз не являются полностью идентичными процессами, протекающими в противоположных направлениях, хотя несколько стадий являются общими для обоих процессов: 7 из 10 ферментативных реакций глюконеогенеза обратны соответствующим реакциям гликолиза. Однако 3 реакции гликолиза необратимы in vivo и не могут использоваться в глюконеогенезе: образование глюкозо-6-фосфата из глюкозы под действием фермента гексокиназы, фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бисфосфата фосфофруктокиназой-1 (PFK-1), а также превращение фосфоенолпирувата в пируват под действием пируваткиназы. В клеточных условиях эти реакции имеют большое отрицательное изменение энергии Гиббса, в то время как другие реакции гликолиза имеют ΔG около 0. При глюконеогенезе три необратимые стадии гликолиза заменены «обходными» реакциями, катализируемыми другими ферментами, и эти реакции также очень экзергоничны и потому необратимы. Таким образом, в клетках как гликолиз, так и глюконеогенез являются необратимыми процессами. У животных гликолиз происходит только в цитозоле, как и большая часть реакций глюконеогенеза, хотя некоторые его реакции происходят в митохондриях и эндоплазматическом ретикулуме. Это даёт возможность для их координированной и взаимно обратной регуляции. Регуляторные механизмы, различающиеся у гликолиза и глюконеогенеза, действуют на ферментативные реакции, уникальные для каждого процесса.
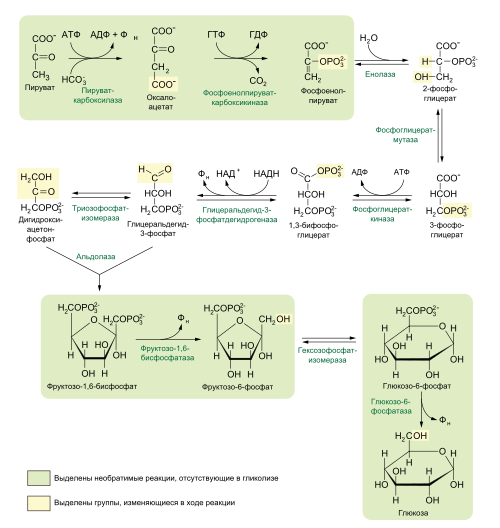
Ниже представлена схема реакций глюконеогенеза:
Стадии
Ниже рассмотрены 3 стадии глюконеогенеза, отличные от реакций гликолиза, проведённых в обратном направлении.
Образование фосфоенолпирувата из пирувата

Первой реакцией глюконеогенеза является превращение пирувата в фосфоенолпируват (ФЕП). Эта реакция не может быть обратной пируваткиназной реакции гликолиза, поскольку пируваткиназная реакция имеет большое отрицательное изменение энергии Гиббса и потому необратима в клеточных условиях. Вместо этого фосфорилирование пирувата осуществляется «окольным путём», для реакций которого у эукариот необходимы и цитозольные, и митохондриальные ферменты.
Вначале пируват переносится из цитозоля в митохондрии или образуется в митохондриях из аланина путём трансаминирования, при котором α-аминогруппа переносится с аланина на α-кетокарбоновую кислоту. После этого митохондриальный фермент пируваткарбоксилаза, для активности которой необходим кофермент биотин, превращает пируват в оксалоацетат:
- Пируват + НСО3- + ATP → оксалоацетат + ADP + Pi.
В этой реакции карбоксилирования участвует биотин как переносчик активированного бикарбоната. HCO3- фосфорилируется с затратой ATP с образованием смешанного ангидрида (карбоксифосфата). После этого на место фосфата в карбоксифосфате присоединяется биотин. Справа показан механизм этой реакции.
Пируваткарбоксилаза является первым регулируемым ферментом глюконеогенеза, её позитивным эффектором служит ацетил-КоА (ацетил-КоА образуется при β-окислении жирных кислот, и его накопление сигнализирует о доступности жирных кислот как энергетического ресурса). Кроме того, пируваткарбоксилазная реакция поставляет промежуточные соединения в другой центральный метаболический путь — цикл трикарбоновых кислот.
Так как в митохондриальной мембране отсутствуют белки-переносчики оксалоацетата, до экспорта в цитозоль образовавшийся при пируваткарбоксилазной реакции оксалоацетат должен быть обратимо восстановлен в малат митохондриальным ферментом малатдегидрогеназой с затратой NADH:
- Оксалоацетат + NADH + H+ ⇌ L-малат + NAD+.
Стандартное изменение энергии Гиббса для этой реакции довольно велико, однако при физиологических условиях (среди которых и очень низкая концентрация оксалоацетата) её ΔG ≈ 0, поэтому эта реакция обратима. Митохондриальная малатдегидрогеназа участвует и в глюконеогенезе, и в цикле трикарбоновых кислот, осуществляя и прямую, и обратную реакции. Оксалоацетат может также переноситься из митохондрии в цитозоль после трансаминирования в аспартат.
Малат покидает митохондрию через специальный белок-транспортер на внутренней митохондриальной мембране, и в цитозоле он вновь окисляется до оксалоацетата с образованием цитозольного NADH:
- Малат + NAD+ → оксалоацетат + NADH + H+.
После этого оксалоацетат превращается в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы. В этой Mg2+-зависимой реакции донором фосфорильной группы выступает GTP:
- Оксалоацетат + GTP ↔ Фосфоенолпируват + СО2 + GDP.
В клеточных условиях эта реакция обратима; образование фосфоенопирувата компенсируется гидролизом другого высокоэнергетичного фосфатсодержащего соединения — GTP.
Общее уравнение для двух первых «обходных» реакций гидролиза выглядит следующим образом:
- Пируват + ATP + GTP + HCO3- → Фосфоенолпируват + ADP + GDP + Pi + CO2; ΔG'o = 0,9 кДж/моль.
Два высокоэнергетичных фосфатных эквивалента (один от ATP и другой GTP), каждый из которых может дать 50 кДж/моль в клеточных условиях, затрачиваются для фосфорилирования одной молекулы пирувата с образованием фосфоенолпирувата. Однако в соответствующей реакции гликолиза (при образовании пирувата из ФЕП) образуется лишь одна молекула ATP из ADP. Хотя стандартное изменение энергии Гиббса ΔG'o в двухшаговом превращении пирувата в фосфоенолпируват равно 0,9 кДж/моль, реальное изменение энергии Гиббса (ΔG), посчитанное с учётом внутриклеточных концентраций соединений, имеет большое отрицательное значение (—25 кДж/моль). Причиной этого является быстрое использование фосфоенолпирувата в других реакциях, так что его концентрация остаётся относительно низкой. По этой причине образование ФЕП из пирувата под действием глюконеогенетических ферментов в клеточных условиях необратимо.
Стоит отметить, что тот же СО2, который присоединяется к пирувату в ходе пируваткарбоксилазной реакции, выделяется при фосфоенолпируваткарбоксикиназной реакции. Такое карбоксилирование-декарбоксилирование является путём «активации» пирувата, то есть декарбоксилирование оксалоацетата способствует образованию фосфоенолпирувата.
Отношение [NADH]/[NAD+] в цитозоле равно 8 × 104, что примерно в 105 раз меньше, чем в митохондриях. Поскольку цитозольный NADH используется в глюконеогенезе (при образовании глицеральдегид-3-фосфата из 1,3-бисфосфоглицерата), биосинтез глюкозы не может происходить, если нет доступного NADH. Транспорт малата из митохондрии в цитозоль и превращение его в оксалоацетат в цитозоле эффективно переносит восстановительные эквиваленты в цитозоль, где их недостаточно. Таким образом, такой путь от пирувата к ФЕП обеспечивает важный баланс между потребляемым и образуемым в цитозоле NADH в ходе глюконеогенеза.
Выше отмечалось, что, кроме пирувата, предшественником для глюконеогенеза также может выступать лактат. Этот путь обеспечивает использование лактата, образовавшегося, например, при гликолизе в эритроцитах или в мышцах при анаэробных условиях. Особенно этот путь важен для крупных позвоночных после тяжёлой физической работы. Преобразование лактата в пируват в цитозоле гепатоцитов приводит к образованию NADH, поэтому в экспорте восстановительных эквивалентов (например, малата) из митохондрий здесь нет нужды. После того как пируват, образовавшийся в лактатдегидрогеназной реакции, транспортируется в митохондрии, он превращается в оксалоацетат под действием пируваткарбоксилазы, как писалось выше. Этот оксалоацетат, однако, превращается непосредственно в фосфоенолпируват митохондриальным изоферментом фосфоенолпируваткарбоксикиназой, а ФЕП выводится из митохондрий в цитозоль, где осуществляются дальнейшие реакции глюконеогенеза.
У растений и некоторых бактерий было обнаружено два фермента, способных образовывать ФЕП непосредственно из пируватата. К их числу относится фосфоенолпируватсинтаза бактерии Escherichia coli. При работе этого фермента его остаток гистидина связывает пирофосфатную группу, взятую от ATP. Далее пирофосфатная группа гидролизуется с выделением фосфата и образованием соединения фермент-His-P. Последний взаимодействует с пируватом, образуя ФЕП. Похожий механизм присущ пируват-фосфатдикиназе, которая впервые была описана у тропических злаков и играет важную роль в С4-фотосинтезе, а также задействована в глюконеогенезе у Acetobacter. Отличие этого фермента от фосфоенолпируватсинтазы заключается лишь в том, что атакующей частицей является не вода, а неорганический фосфат.
Образование фруктозо-6-фосфата из фруктозо-1,6-бисфосфата
Второй реакцией гликолиза, которая не может дублироваться обратной реакцией в глюконеогенезе, является фосфорилирование фруктозо-6-фосфата фосфофруктокиназой-1. Так как эта реакция высоко экзергонична и поэтому необратима в клеточных условиях, образование фруктозо-6-фосфата из фруктозо-1,6-бисфосфата катализируется другим ферментом — Mg2+-зависимой фруктозо-1,6-бисфосфатазой-1 (FBPаза-1), которая катализирует необратимый гидролиз фосфата при первом атоме углерода (а не перенос фосфорильной группы на ADP):
- Фруктозо-1,6-бисфосфат + Н2О → фруктозо-6-фосфат + Pi, ΔG'o = −16,3 кДж/моль.
Кроме фруктозо-1,6-бисфосфатазы-1 существует фруктозо-1,6-бисфосфатаза-2, выполняющая регуляторные функции.
Образование глюкозы из глюкозо-6-фосфата
Третья «обходная» реакция является последней реакцией глюконеогенеза: дефосфорилирование глюкозо-6-фосфата с образованием глюкозы. Если бы гексокиназа осуществляла эту обратную реакцию, то ей бы сопутствовал перенос фосфорильной группы с глюкозо-6-фосфата на ADP с образованием ATP, что энергетически невыгодно. Реакция, катализируемая глюкозо-6-фосфатазой, не включает синтеза ATP и представляет собой простой гидролиз фосфатного эфира:
Этот Mg2+-зависимый фермент встречается на люменальной стороне эндоплазматического ретикулума гепатоцитов, в клетках почек и эпителиальных клетках тонкой кишки, однако в других тканях его нет, поэтому остальные ткани неспособны поставлять глюкозу в кровь. Если бы в них была глюкозо-6-фосфатаза, то она бы гидролизовала глюкозо-6-фосфат, который необходим этим тканям для гликолиза. Глюкоза, образовавшаяся в ходе глюконеогенеза в печени и почках или поглощённая с пищей разносится по кровотоку к этим тканям, в числе которых — мозг и мышцы.
Энергетика
Суммарное уравнение биосинтетических реакций глюконеогенеза, приводящих к образованию глюкозы из пирувата, выглядит так:
- 2 Пируват + 4ATP + 2GTP + 2NADH + 2H+ + 4H2O → глюкоза + 4ADP + 2GDP + 6Pi + 2NAD+.
На каждую молекулу глюкозы, образовавшуюся из пирувата, необходимо 6 высокоэнергетичных фосфатных групп, 4 из которых берутся от ATP и 2 — от GTP. Кроме того, для восстановления двух молекул 1,3-бисфосфоглицерата необходимы 2 молекулы NADH. В то же время для гликолиза нужны лишь 2 молекулы ATP. По этой причине синтез глюкозы из пирувата является затратным процессом. Большая часть затрачиваемой энергии обеспечивает необратимость глюконеогенеза. В клеточных условиях суммарное изменение энергии Гиббса при гликолизе составляет −63 кДж/моль, а при глюконеогенезе — −16 кДж/моль. Таким образом, в клеточных условиях и гликолиз, и глюконеогенез необратимы.
Другие предшественники глюкозы
Описанный выше биосинтетический путь образования глюкозы относится к синтезу глюкозы не только из пирувата, но также 4-, 5- и 6-углеродных промежуточных соединений цикла трикарбоновых кислот. Цитрат, изоцитрат, α-кетоглутарат, сукцинил-СоА, сукцинат, фумарат и малат — все промежуточные продукты цикла трикарбоновых кислот могут окисляться до оксалоацетата. Некоторые или все атомы углерода большей части аминокислот могут быть катаболизированы в пируват или промежуточные соединения цикла трикарбоновых кислот. Поэтому эти аминокислоты могут подвергнуться превращению в глюкозу и называются глюкогенными. Аланин и глутамин — важнейшие молекулы, переносящие аминогруппы в печень из других тканей — служат особенно важными глюкогенными аминокислотами у млекопитающих. После того, как эти аминокислоты отдают свои аминогруппы в митохондриях печени, их углеродные скелеты (пируват и α-кетоглутарат соответственно) вовлекаются в глюконеогенез. Аминокислоты образуются при распаде белков мышц и соединительной ткани, их включение в глюконеогенез происходит при продолжительном голодании или длительной физической нагрузке.
У растений, дрожжей и многих бактерий имеется путь, позволяющий получать углеводы из жирных кислот — глиоксилатный цикл. У животных ключевых ферментов этого цикла нет, и, ввиду необратимости пируватдегидрогеназной реакции, они не могут получать пируват из ацетил-КоА, а значит, образовывать углеводы из жирных кислот (следовательно, и из липидов). Тем не менее, они могут использовать для глюконеогенеза те небольшие количества глицерола, который образуется при распаде жиров. При этом глицерол фосфорилируется глицеролкиназой, далее следует окисление центрального атома углерода с образованием дигидроксиацетонфосфата, который является промежуточным соединением глюконеогенеза.
Глицеролфосфат является необходимым промежуточным соединением при синтезе жиров (триглицеридов) в адипоцитах, однако эти клетки лишены глицеролкиназы и поэтому не могут осуществлять фосфорилирование глицерола. Вместо этого адипоциты могут осуществлять сокращённый вариант глюконеогенеза, известный как глицеронеогенез: преобразование пирувата в дигидроксиацетонфосфат через первые реакции глюконеогенеза, вслед за которым следует восстановление дигидроксиацетонфосфата до глицеролфосфата.
Регуляция
Если бы гликолиз и глюконеогенез протекали одновременно и на большой скорости, то результатом стали бы расход ATP и образование тепла. Например, фосфофруктокиназа-1 и фруктозо-1,6-бисфосфатаза-1 катализируют противоположные реакции:
- ATP + фруктозо-6-фосфат → ADP + фруктозо-1,6-бисфосфат (PFK-1)
- Фруктозо-1,6-бисфосфат + H2O → фруктозо-6-фосфат + Pi (FBPаза-1).
Суммой этих двух реакций является
- ATP + H2O → ADP + Pi + теплота.
Эти две ферментативные реакции, как и ряд других реакций этих двух путей, регулируются аллостерически и ковалентных модификаций. Гликолиз и глюконеогенез регулируются реципрокно, то есть если поток глюкозы, проходящей через гликолиз, растёт, то поток пирувата, проходящего через глюконеогенез, спадает, и наоборот. Например, FBPаза-1 строго подавляется аллостерическим связыванием AMP, так что когда клеточные запасы ATP невелики, а уровень AMP высок, ATP-зависимый синтез глюкозы приостанавливается, а катализирующая соответствующую реакцию гликолиза PFK-1, наоборот, активируется AMP. Хотя PFK-1 активируется фруктозо-2,6-бисфосфатом, на FBPазу-1 это соединение имеет противоположный эффект: он снижает его сродство к субстратам и тем самым замедляет глюконеогенез.
На пути преобразования пирувата в глюкозу первой контрольной точкой, на которой определяется дальнейшая судьба пирувата в митохондрии, является то, будет ли он превращён в ацетил-КоА пируватдегидрогеназным комплексом с дальнейшим вовлечением в цикл трикарбоновых кислот или же в оксалоацетат под действием пируваткарбоксилазы, чтобы начать глюконеогенез. Когда в качестве источника энергии доступны жирные кислоты, то при их разложении в митохондриях образуется ацетил-КоА, выступающий в качестве сигнала о том, что в дальнейшем окислении глюкозы нет нужды. ацетил-КоА являются положительным аллостерическим модулятором пируваткарбоксилазы и отрицательным модулятором пируватдегидрогеназного комплекса; его действие опосредуется стимуляцией протеинкиназы, которая инактивирует дегидрогеназу. Когда энергетические потребности клетки удовлетворены, окислительное фосфорилирование замедляется, концентрация NADH по сравнению с NAD+ увеличивается, цикл трикарбоновых кислот подавляется, и происходит накопление ацетил-КоА. Повышенная концентрация ацетил-КоА подавляет пируватдегидрогеназный комплекс, тем самым замедляя образование ацетил-КоА из пирувата и стимулируя глюконеогенез через активацию пируваткарбоксилазы, что позволяет превратить излишек пирувата в оксалоацетат (а впоследствии и глюкозу).
Полученный таким образом оксалоацетат превращается в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы. У млекопитающих регуляция этого важнейшего фермента глюконеогенеза осуществляется на уровне его синтеза и распада под влиянием режима питания и гормональных сигналов. Так, его промотор имеет 15 или более регуляторных элементов, распознаваемых по крайней мере 12-ю известных транскрипционных факторов, и, как предполагается, ещё большим числом пока не описанных. Голодание или высокий уровень глюкагона увеличивают транскрипцию этого фермента и стабилизируют его мРНК. Действие глюкагона опосредовано транскрипционным фактором CREB (англ. cyclic AMP response element binding protein), который активирует синтез глюкозо-6-фосфатазы и фосфоенолпируваткарбоксилазы в ответ на вызванное глюкагоном увеличение внутриклеточной концентрации cAMP. Инсулин или высокое содержание глюкозы в крови имеют противоположный эффект. Эти изменения, вызываемые в основном внеклеточными сигналами (питание, гормоны), могут длиться от нескольких минут до нескольких часов. Инсулин также замедляет экспрессию генов глюкозо-6-фосфатазы и фруктозо-1,6-бисфосфатазы. Другим транскрипционным фактором, регулирующим экспрессию генов ферментов глюконеогенеза, является FOXO1 (англ. forkhead box other). Инсулин активирует протеинкиназу В, которая фосфорилирует FOXO1, находящийся в цитозоле. С фосфорилированным FOXO1 связывается убиквитин, и FOXO1 разрушается в протеасоме, однако в отсутствие фосфорилирования или при дефосфорилировании FOXO1 может проникать в ядро, связываться с соответствующим регуляторным элементом на ДНК и запускать транскрипцию генов фосфоенолпируваткарбоксикиназы и глюкозо-6-фосфатазы. Фосфорилированию FOXO1 протеинкиназой В препятствует глюкагон.
Клиническое значение
При снижении использования лактата в качестве субстрата для глюконеогенеза, которое может вызываться дефектом ферментов глюконеогенеза, концентрация лактата в крови повышается, что приводит к понижению pH крови и развитию лактатацидоза. Стоит отметить, что кратковременный лактатацидоз встречается и у здоровых людей при интенсивной мышечной работе, в этом случае он компенсируется путём гипервентиляции лёгких и ускоренным выведением углекислого газа.
На глюконеогенез существенное влияние оказывает этанол. В результате его катаболизма увеличивается количество NADH, что смещает равновесие в лактатдегидрогеназной реакции в сторону образования лактата, снижению образования пирувата и замедлению глюконеогенеза.
Литература
- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells.. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.